Гиперандрогения представляет собой патологию, для которой характерен повышенный уровень андрогенов, т.е. мужских половых гормонов, в женском организме. Как следствие, это вызывает определенные болезненные состояния. Что же это за явление? И какие последствия могут быть? Поговорим об этом подробнее.
Клинически гиперандрогения проявляется в виде себореи, гирсутизма, акне. Примечательно, что в целом ряде случаев уровень андрогенов все же может оставаться в пределах нормы. Зачастую гиперандрогения вызывает изменения в структуры яичников.
Исследования подтвердили, что сохранение уровня андрогенов в норме на фоне развития гиперандрогении обусловлено специфическим механизмом развития заболевания.
Как правило, это связывается с тем, что процессы преобразования мужских половых гормонов изменяются. В результате получаются более активные формы гормонов, к примеру, дигидротестостерон.
Каким образом проявляется гиперандрогения?

Иные симптомы, которыми характеризуется гиперандрогения, – это:
- сбои в менструальном цикле. В отдельных случаях наблюдается аменорея, т.е. отсутствие месячных;
- ановуляцию. Этот процесс характеризуется тем, что яйцеклетка не выходит из созревшего фолликула. В результате развивается бесплодие;
- гиперэстрогенемию. Это явление обусловлено дисбалансом между женскими половыми гормонами. Гиперэстрогенемия опасна риском развития рака шейки матки;
- понижение чувствительности тканей организма к инсулину. Этот симптом, к тому же, сам по себе является предпосылкой для нарушения углеводного и жирового обмена. Последнее, в свою очередь, вызывает сахарный диабет 2-го типа, ожирение, развитие сердечно-сосудистых заболеваний и атеросклероза.
Разновидности заболевания
Гиперандрогения у женщин имеет несколько видов, которые различаются в зависимости от того, какой именно фактор преобладает в развитии заболевания.
Соответственно, выработана классификация, включающая в себя сразу несколько клинических форм, определение конкретной из которых способствует выбору наиболее подходящей методики, в соответствии с которой будет осуществляться лечение.
Итак, выделяют:
- центральную гиперандрогению. О ней говорят тогда, когда имеются заболевания и опухоли гипофиза, а также если нарушена функция гипоталамуса;
- надпочечниковую гиперандрогению. Она связана, прежде всего, с опухолью надпочечников;
- яичниковую гиперандрогению. Для этой разновидности характерны поликистоз и гипертекоз яичников, а также андрогенопродуцирующие опухоли яичников;
- смешанную форму. Что это за разновидность? Она обусловлена сразу несколькими нарушениями. Например, о смешанной гиперандрогении говорят при сбоях в функционировании надпочечников и яичников или при метаболическом синдроме сложного генеза;
- периферическую гиперандрогению. Эта разновидность наблюдается при сахарном диабете, сбоях в обмене жиров, при наличии наследственных договоров.
Чаще всего встречаются две разновидности гиперандрогении: надпочечниковая и яичниковая. О них и поговорим подробнее.
Яичниковая гиперандрогения
Основной причиной возникновения яичниковой гиперандрогении является синдром поликистозных яичников. Как проявляется заболевание?
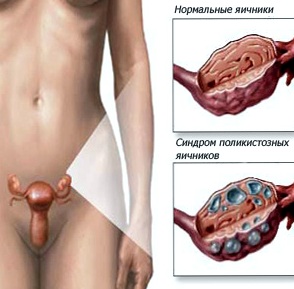
Прежде всего, сам поликистоз яичников связан с дефицитом ферментов, которые содержатся в яичниках. Речь идет именно о наследственном дефиците.
Он препятствует преобразованию сугубо мужских андрогенов в женские половые гормоны. Соответственно, андрогены накапливаются, а в результате образуется гиперандрогения.
Яичниковая гиперандрогения связана с развитием гормональных нарушений в гипоталамусе и гипофизе.
Кроме того, обычно происходит нарушение баланса ряда других гормонов в женском организме, в частности, ЛГ, ФСГ, эстрадиол и пролактин.
Еще одной причиной развития яичниковой гиперандрогении являются андрогенопродуцирующие опухоли. Также такие опухоли могут вызывать существенное увеличение содержания других, отдельно взятых гормонов.
Помимо прочего, яичниковая гиперандрогения может быть смешана с центральной. Подобная ситуация наблюдается вследствие перенесенных травм, интоксикаций мозга, опухолей гипофиза.
В результате отмечается сбой в физиологической стимуляции работы яичников, что, в свою очередь, вызывает повышение уровня содержания в крови иного гормона – пролактина, на фоне снижения содержания иных гормонов.
Надпочечниковая гиперандрогения

Эта разновидность также встречается достаточно часто. Среди причин в большинстве случаев встречается так называемый адреногенитальный синдром.
Данный синдром проявляется в отсутствии либо недостаточности ферментов, обеспечивающих синтез гормонов, располагающихся в коре надпочечников. Именуются эти ферменты глюкокортикоидами.
Раз они отсутствуют, то все вещества, обычно идущие на их переработку, начинают использоваться организмом для выработки андрогенов. По этой причине гиперандрогения может наблюдаться уже с самого детства.
Зачастую наблюдается сочетание двух рассмотренных разновидностей гиперандрогении.
Кроме того, надпочечниковая гиперандрогения порой сочетается с некоторыми другими заболеваниями, поскольку пролактин, который обуславливает выработку андрогенов, одновременно препятствует продукции иных, сугубо женских гормонов.
Протекание беременности при гиперандрогении

Бесплодие — одно из последствий, которые вызывает чрезмерное количество андрогенов.
Как уже отмечалось, среди последствий, которые вызывает чрезмерное количество андрогенов, называют также и бесплодие. Остановимся на этом аспекте подробнее.
Дело в том, что заболевание наиболее негативно сказывается на яичниках. Кроме того, на первых этапах наблюдается торможение созревания яйцеклетки. В последующем, по мере развития заболевания, происходит уплотнение яичника.
Также уплотняется и оболочка, а внутренняя структура становится благодатной почвой для возникновения большого числа мелких кист.
Получается, что даже при созревании яйцеклетки становится невозможным ее выход. Иными словами, чисто технически возможность оплодотворения исключена.
Но в некоторых случаях все же возможно наступление беременности. К сожалению, сочетание гиперандрогении и беременности вызывает либо самопроизвольное прерывание беременности на ранних сроках, либо замирание беременности.
Именно поэтому очень важно уделять должное внимание первым симптомам гиперандрогении и вовремя ее распознать.
В противном случае высок риск усугубления положения: так, прерывание беременности отрицательно сказывается на соотношении гормонов в организме женщине, вызывая дисбаланс. В конечном итоге наступление беременности и вовсе становится невозможным.
Диагностика
Обнаружив первые признаки, любой женщине необходимо немедленно обратиться к врачу. Специалист, изучив жалобы пациентки, назначает обследование. Также на необходимость исследования женщины на предмет отсутствия гиперандрогении указывает и бесплодие в сочетании с некоторыми признаками.
В рамках обследования проводятся различные гормональные исследования, которые направлены на выявление отклонений в уровне содержания отдельных гормонов. Используется также метод ультразвукового исследования (УЗИ), некоторые другие специфические методы.
После диагностики определяется наиболее подходящее для каждого конкретного случая лечение. Если методика будет выбрана правильно и самое главное – своевременно, то уже в скором времени для женщины станет возможным зачатие и вынашивание ребенка.
В том случае, когда диагностика проводилась в период беременности, то обнаруженная гиперандрогения обусловит необходимость в назначении особых препаратов, действие которых направленно на снижение уровня андрогенов в крови.
Лечение
Итак, мы установили, какие симптомы указывают на наличие гиперандрогении. Были установлены последствия данного заболевания. Ознакомились также с классификацией заболевания и характеристиками двух наиболее распространенных разновидностей.
Отдельно были определены особенности протекания беременности на фоне гиперандрогении. Наконец, были описаны основные методы, которые используются в ходе диагностики заболевания. Теперь необходимо остановиться на вопросе лечения гиперандрогении.
Прежде всего, отметим, что выбор конкретного направления, в рамках которого будет происходить лечение, зависит от нескольких факторов одновременно:
- Разумеется, свою роль играет то, какая разновидность гиперандрогении имеет место;
- Также учитывается характер протекания заболевания.
В соответствии с этими обстоятельствами определяется конкретное лечение. Так, если гиперандрогения не сопровождается повышенным содержанием андрогенов, то врачи обычно назначают таблетированные препараты различных комбинированных оральных контрацептивов.
Такие препараты содержат антиандрогены. Речь идет, например, о препаратах «Ярина», «Андрокур», «Жаннин».
Однако перед их назначением следует обратить внимание на ряд противопоказаний, в числе которых:
- наличие тромбозов любого вида (включая и те, что развиваются при анамнезе);
- заболевания печени тяжелого характера;
- сахарный диабет, сопровождающийся явлениями ангиопатии;
- так называемый синдром диабетической стопы;
- наличие опухолей молочных желез, гормонозависимых опухолей матки и яичников, опухолей печени и надпочечников;
- эндометриоз;
- беременность и период лактации;
- индивидуальная непереносимость.
Как видим, перечень достаточно внушительный. Следовательно, перед применением вышеуказанных препаратов важно проконсультироваться с эндокринологом.
Отдельное лечение применяется в тех случаях, когда женщины при наличии симптомов гиперандрогении планируют беременность. В таких случаях специалистами, как правило, принимается решение о проведении гормональной терапии, которая должна обеспечить стимуляцию овуляции.
Этот метод имеет один существенный плюс: во многих случаях в результате терапии гиперандрогения полностью исчезает, включая все ее внешние признаки.
В ряде случаев УЗИ может выявить, что отсутствие овуляции вызвано склеротическими изменениями в капсуле яичника. Тогда проводится оперативное лечение, которое сочетается с гормональной терапией.
Какое еще лечение применяются? Разумеется, не обходится и без хирургического вмешательства. Так, необходимость в этом возникает тогда, когда обнаруживаются опухоли яичников и надпочечников.
Дело в том, что практически невозможно предсказать, каким именно будет развитие этих опухолей. Поэтому и прибегают к их хирургическому удалению.
В тех случаях, когда у женщин наблюдается надпочечниковая гиперандрогения, используются кортикостероиды (такие, как преднизолон, например).
В ходе лечения этими препаратами важно определить, какая минимальная доза необходима для того, чтобы нормализовать деятельность надпочечников.
Встречаются и иные способы лечения, которые применяются при наличии иных симптомов, сопровождающих гиперандрогению:
а) лечение с помощью ингибиторов, продуцирующих пролактин (например, используется бромериптин). Метод используется при смешанной гиперандрогении (надпочечниковой и яичниковой);
б) лечение посредством назначение препарата «Климен», который обладает антиандрогенным действием. Применяется в период менопаузы;
в) косметических процедурах. Их проведение возможно только после предварительной консультации специалиста.
Итоги
В завершении приведем основные положения, касающиеся гиперандрогении:
- Это явление встречается у 10-20% женщин;
- Первые симптомы заболевания – это гирсутизм, алопеция, барифония, маскулинизацию;
- Существует несколько разновидностей заболевания, но основными являются яичниковая и надпочечниковая гиперандрогения;
- Конкретное лечение зависит от того, какими именно признаками сопровождается заболевание.
Гиперандрогения – это эндокринное заболевание, вызванное усиленной секрецией мужских половых гормонов в организме женщины. Андрогены вырабатываются яичниками и корой надпочечников. В зависимости от первичной причины патологии, могут отличаться клинические симптомы.
Гиперандрогения у женщин вызывает усиленную секрецию лютеинизирующего гормона в гипофизе, что блокирует высвобождение фолликулостимулирующего гормона и эстрадиола. В результате нарушается процесс созревания фолликула, не происходит выход яйцеклетки (ановуляция). Высокий уровень андрогенов способствует образованию множественных кист в яичниках (синдром поликистозных яичников).
Мужские гормоны снижают восприимчивость периферических тканей к инсулину, это приводит к повышению уровня глюкозы в крови, нарушению толерантности к глюкозе, углеводного обмена и развитию сахарного диабета 2 типа.
Классифицируют истинную и идиопатическую гиперандрогению. В первом случае в крови женщины увеличен уровень андрогенов, а во втором повышена чувствительность рецепторов периферических тканей к мужским гормонам.
Причины патологии
Что такое – гиперандрогения и почему она возникает? Основными причинами заболевания являются:
- опухоли, метастазы надпочечников;
- нарушение гипоталамо-гипофизарной регуляции, вызванное травмами, опухолями, воспалительными заболеваниями головного мозга;
- опухоли яичников: лютеома, текома;
- андрогенитальный синдром – врожденная патология коры надпочечников, при которой происходит усиленная выработка тестостерона.
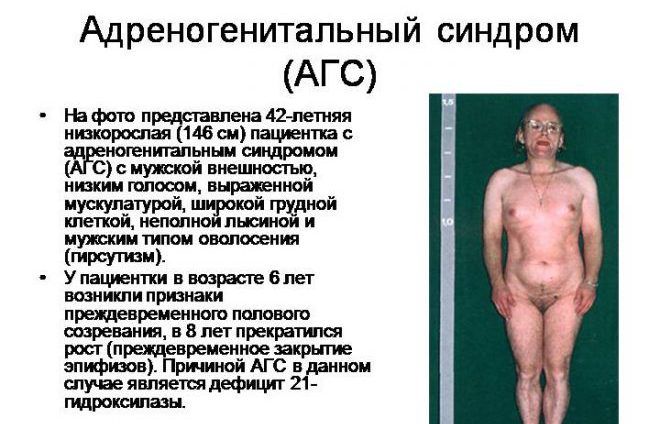
У женщин причины гиперандрогении вызывают нарушение гормонального баланса, функционирования репродуктивной системы, метаболических процессов в организме.
Симптомы яичниковой гиперандрогении
Заболевание бывает яичникового и надпочечникового генеза — в зависимости от органа, который начинает усиленно вырабатывать андрогены. Яичниковая гиперандрогения в большинстве случаев развивается на фоне синдрома поликистозных яичников, реже патологию вызывают гормонпродуцирующие опухоли.
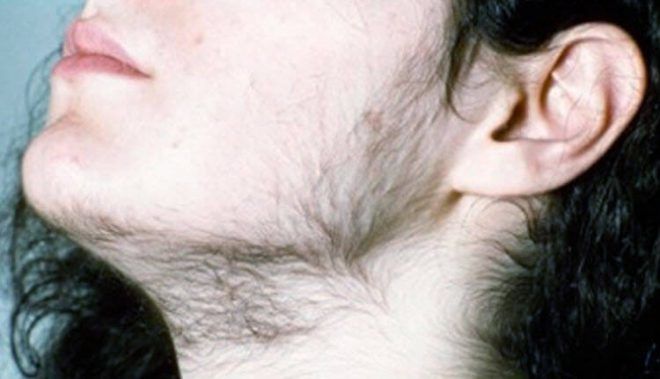
СПКЯ характеризуется нарушением менструального цикла, бесплодием, повышением уровня андрогенов в крови. Фигура девушки изменяется по мужскому типу, начинают расти волосы на лице и теле, увеличивается объем талии, груди, жировая прослойка откладывается в нижней части живота. Нарушается работа сальных желез, появляется себорея, угревая сыпь, которая не поддается лечению. На коже бедер, ягодиц появляются растяжки-стрии. Ночное апноэ (задержка дыхания) приводит к бессоннице.
На фото женщина с характерными признаками гирсутизма.
Характерные симптомы гиперандрогении при СПКЯ – это появление предменструального синдрома. Женщины становятся раздражительными, у них часто меняется настроение, беспокоит мигрень, интенсивные боли внизу живота, набухание, болезненность молочных желез.
Яичники в 2–3 раза увеличиваются в размерах, их капсула утолщается. Внутри органа обнаруживаются множественные кистозные образования. Гормональный дисбаланс вызывает утолщение и гиперплазию эндометрия матки, месячные становятся более продолжительными, обильными, с выделением кровяных сгустков.
Гиперандрогения – повышение количества мужских половых гормонов у женщин сверх нормального уровня. Это эндокринное отклонение диагностируется у 5% женщины. Возникает оно либо от повышенной выработки мужских гормонов, либо от чрезмерной чувствительности тканей и органов к таковым.
В организме каждой женщины вырабатываются мужские половые гормоны – андрогены. Продуцируют их яичники – женские половые железы, и надпочечники – эндокринные органы, расположенные над почками. Диагноз гиперандрогения ставят при избыточной выработке андрогенов этими двумя железами.
Симптомы развивающейся гиперандрогении у женщин
Большой уровень андрогенов нередко приводит к образованию мелких кист и формированию из таковых плотной капсулы вокруг яичника. Также нарушение приводит к ановуляции, что влечет за собой бесплодие.
Если беременность все же наступает, очень высока вероятность ее преждевременного прерывания на начальных сроках. Риск выкидыша снижается во втором триместре.
Невынашивание обусловлено большим количеством мужских половых гормонов и низким прогестеронов – гормонов беременности. Недостаток прогестеронов также входит в симптоматику гиперандрогении.
Отклонения в работе яичников отражается на регулярности менструального цикла. Если в норме первые месячные наступают в 12-13 лет, то при врожденной гиперандрогении на несколько лет позже. При этом они нерегулярные, могут задерживаться, чередоваться с длительными выделениями.
Женщины с таким диагнозом относятся к группе риска по развитию осложнений при родах, например, наиболее часто у них несвоевременно отходят околоплодные воды и присутствует слабая родовая деятельность. Поэтому женщина с таким диагнозом даже при успешном зачатии должна находиться под пристальным наблюдением врачей. В данном случае необходимо следить за показателями базальной температуры и рядом других, чтобы своевременно выявить осложнение в течение беременности.
В симптомы отклонения входит гирсутизм – усиленный рост волос на теле, в основном на руках и ногах. Когда причиной заболевания является нарушение работы гипофиза, присутствует и ожирение. Признаком отклонения являются дефекты кожи, к примеру, акне, которые в народе называют угрями.
Заболевание сопровождается повышением чувствительности тканей к инсулину. При этом его уровень в крови постоянно повышается, что в свою очередь увеличивает риск развития сахарного диабета.
Почему возникает синдром гиперандрогении у женщин
Чаще всего отклонение возникает в результате так называемого андрогенитального синдрома. Как известно, надпочечники вырабатывают не только андрогены, но и ряд других, не менее важных, веществ, включая глюкокортикоиды. Большое количество андрогенов под действием особого фермента в яичниках превращается в глюкокортикоиды.
Выработка этих ферментов обусловлена на генетическом уровне. Когда женщина рождается с патологией этого фермента, вырабатывающиеся в ее организме андрогены не могут превратиться в глюкокортикоиды и все время накапливаются, оказывая негативное воздействие на здоровье.
На гормональный фон может повлиять опухоль надпочечников. Чем больше клеток вырабатывает андрогены, тем выше количество последних. Это касается и новообразований в яичниках.
Рост количества мужских гормонов может быть обусловлен патологией других органов эндокринной системы, к примеру, гипофиза, который регулирует работу остальных желез внутренней секреции.
Гиперандрогения может возникать и при повышенной чувствительности к тестостерону. В основном симптомы этой формы заболевания – гирсутизм и акне. Однако в данном случае увеличения андрогенов в крови не наблюдается, гормональный фон не дает сбоев.
Как диагностируется гиперандрогения у женщин
Первое, на что обращает внимание доктор, – время появления симптомов заболевания. Стоит отметить, что они могут развиваться постепенно, с начала периода полового созревания, либо внезапно, уже в репродуктивном возрасте. Этот момент позволяет подтвердить или опровергнуть связь нарушения с опухолью надпочечников или яичников.
В целях диагностики прибегают к различным исследованиям:
- Анализы мочи и крови позволяют определить уровень андрогенов, продуктов их распада и ряд других веществ;
- УЗИ половых органов;
- Томография и ультразвуковое исследование надпочечников.
Если есть необходимость, применяют и другие методы диагностики.
Лечение синдрома гиперандрогении у женщин
Методы восстановления гормонального фона в первую очередь зависят от формы заболевания. К примеру, если повышенная выработка андрогенов обусловлена опухолевой тканью надпочечников или яичников, прибегают к хирургическому вмешательству.
Когда причиной сбоя является не опухоль, а нарушение работы гипоталамуса/гипофиза, лечение зависит от двух факторов: причины отклонения и целей врача/пациента. Например, усилия могут быть направлены на устранение внешних проявлений заболевания (гирсутизма, акне) или восстановление репродуктивной функции при бесплодии.
Если причины заболевания скрывается в нарушении работы гипофиза с гипоталамусом, присутствует значительное ожирение. В данной ситуации нормализация веса становится одной из главных целей лечения.
В этих целях прибегают к диетам (снижению калорийности пищи) и спорту (повышению физической активности), применению седативных препаратов (рудотель, перитол, дифенин). Врач может порекомендовать курс иглорефлексотерапии.
Если женщина не планирует беременность в ближайшее время, то гиперандрогения, а точнее ее симптомы, устраняется с помощью оральных контрацептивов с антиандрогенным действием.
Надпочечниковая гипоандрогения предполагает во время подготовки к беременности прием дексаметазона. У большинства женщин после терапии нормализуется менструальный цикл, происходит регулярная овуляция, наступает долгожданная беременность.
Головной мозг остро реагирует на сбои гормонального фона. В результате различные системы организма дают сбои. Но после введения недостающего гормона из вне отклонения устраняются. Гиперандрогения при беременности требует приема препаратов этого ряда на этапе подготовки и планирования.
При бесплодии, обусловленным этим отклонением, назначают медикаментозные средства, стимулирующие выход яйцеклетки или яичника. Например, чаще всего выписывают Клостилбегид, Кломифен.

Когда медикаменты для стимуляции овуляции оказываются малоэффективными, прибегают к хирургическому вмешательству.
Современная медицина вместо обширных операций прибегает к лапароскопии: в брюшной стенке делают небольшой разрез, через который вводят специальные хирургические инструменты, включая микрокамеру, позволяющую видеть процесс операции.
С помощью такого инновационного оборудования на яичниках, покрытых плотными капсулами, делают насечки, сквозь которые впоследствии выйдет яйцеклетка.
На этапе планирования беременности, а также на начальных сроках таковой назначают ряд общеукрепляющих препаратов. Чаще всего это фолиевая кислота и другие витаминно-минеральные добавки.
Гиперандрогения – серьезное отклонение, требующее тщательного обследования. При появлении тревожных симптомов необходимо обратиться к специалисту. Это может быть гинеколог или эндокринолог. Своевременное выявление патологии и принятие мер позволит сохранить репродуктивную функцию или восстановить таковую при лечении женского и мужского бесплодия.
Гиперандрогенные проявления наблюдаются у больных с патологией печени и желчевыводящих путей, с дефицитом витаминов, минералов и микроэлементов, порфирией и дерматомиозитом, с хроническими заболеваниями почек и дыхательной системы, в том числе на фоне туберкулезной интоксикации.
Действие андрогенов на волосы зависит от их типа и локализации. Рост волос в подмышечных и лобковой областях стимулируют даже небольшие количества андрогенов, поэтому он начинается на ранних стадиях полового развития (адренархе), когда уровни андрогенов низки и они секретируются надпочечниками. Волосы на груди, животе и лице появляются в присутствии гораздо больших количеств андрогенов, которые в норме секретируются только яичками. Рост волос на голове при высоких уровнях андрогенов подавляется, в результате появляются залысины надо лбом. На рост пушковых волос, ресниц и бровей андрогены не влияют.
Рост волос происходит циклически. Выделяют стадию роста волоса (анаген), переходную стадию (катаген) и стадию покоя (телоген). Во время последней волос не растет и выпадает. Продолжительность указанных стадий зависит от локализации волос. Разные волосы всегда находятся в разных стадиях роста. Изменение продолжительности стадий роста волоса приводит к алопеции.
В организме женщины основными структурами, способными синтезировать стероидные гормоны, являются надпочечники и яичники. В цепи превращений прогормонов в андрогены и их метаболиты существует 4 последовательные фракции, обладающие нарастающей андрогенной активностью – дегидроэпиандростерон (ДЭА), андростендион (А), тестостерон (Т) и дигидротестостерон (ДГТ).
Надпочечники являются главной структурой, синтезирующей ДЭА (70%) и его менее активный метаболит - дегидроэпиандростерона сульфат (85%). Вклад надпочечников в синтез А приближается к 40-45%. Важно отметить, что надпочечниками синтезируется лишь 15-25% от общего пула Т. В сетчатой зоне коры надпочечников имеются ферменты 17, 20-лиаза и 17?-гидроксилаза, способные последовательно превращать холестерин, содержащийся в липопротеинах низкой плотности (Х-ЛПНП) или образующийся местно из ацетата, через 17-гидроксипрегненолон (17-ОН-прегненолон) в ДЭА.
Кроме того, клетки сетчатой зоны при помощи фермента 3?-гидроксистероид-дегидрогеназы (3?-НSD) обладают способностью переводить 17-ОН-прегненолон в 17-гидроксипрогестерон (17-ОН-прогестерон), а уже его и ДЭА в А .
Веретенообразные клетки (тека-клетки) ячеистой внутренней оболочки (theca interna), фолликулов и интерстициальные клетки стромы яичников обладают способностью синтезировать 25% Т. Основным продуктом биосинтеза андрогенных стероидов в яичниках является А (50%). Вклад яичников в синтез ДЭА ограничен 15%. Ароматизация А и Т до эстрона (Е1) и эстрадиола (Е2) происходит в клетках гранулезы развивающегося доминантного фолликула.
Синтез андрогенных стероидов управляется лютеинизирующим гормоном (ЛГ), рецепторы к которому имеются на поверхности как тека-клеток, так и клеток гранулезы фолликула. Превращение андрогенов в эстрогены регулируется фолликулостимули-рующим гормоном (ФСГ), рецепторы к которому имеют только клетки гранулезы .
Приведенные данные свидетельствуют, что основной источник продукции Т (60%) у женщин находится вне яичников и надпочечников. Этим источником являются печень, строма подкожной жировой клетчатки и волосяные фолликулы. При помощи фермента 17?-гидроксистероиддегидрогеназы (17?-НSD) андростендион (А) в строме жировой ткани и в волосяных фолликулах превращается в тестостерон (Т). Более того, клетки волосяных фолликулов секретируют 3?-НSD, ароматазу и 5?-редуктазу, что позволяет им синтезировать ДЭА (15%), А (5%) и наиболее активную андрогенную фракцию ДГТ .
Андростендион и тестостерон, превращаясь под влиянием ароматазы соответственно в Е1 и Е2, повышают количество рецепторов к эстрогенам и андрогенам в клетках волосяных фолликулов, ДЭА и ДЭА-сульфат стимулируют активность сальных желез волосяного фолликула, а ДГТ ускоряет рост и развитие волос .
Можно выделить следующие механизмы развития гиперандрогении и гирсутизма при синдроме поликистозных яичников и болезни поликистозных яичников:
1. Действие гиперандрогении на уровне тканей-мишеней - волосяных фолликулов связывают с увеличением синтеза тестостерона в тека-клетках и строме ПКЯ под влиянием повышенных концентраций ЛГ.
2. При часто сопутствующей СПКЯ инсулинорезистентности инсулин усиливает синтез тестостерона в яичниках.
3. У больных ожирением повышена продукция тестостерона в жировой ткани.
4. Повышение концентрации тестостерона и инсулина подавляет синтез в печени половых стероидосвязывающих глобулинов, что приводит к увеличению содержания в крови свободных, биологически более активных фракций андрогенов .
Трудности диагностики гиперандрогенных проявлений могут быть связаны:
с тесной взаимосвязью функций яичников, надпочечников, гипоталамуса и гипофиза;
неполноценностью развития центральных и периферических звеньев репродуктивной системы;
генетическими мутациями, которые проявляются к периоду полового созревания;
прогрессирующим ростом гормонопродуцирующих клеток яичников, надпочечников, гипофиза и гипоталамических структур;
повышенной чувствительностью волосяных фолликулов к андрогенам и их активным метаболитам;
нарушением механизмов, обеспечивающих связывание Е2 и Т с белковыми соединениями (ПССГ);
приемом гормональных и антигормональных средств с андрогенными свойствами (даназол, гестринон, норэтистерон, норэтинодрел, аллилэстренол, в меньшей степени норгестрел, левоноргестрел и медроксипрогестерон);
постоянным дефицитом кортизола, который стимулирует секрецию адренокортикотропного гормона (АКТГ), что и служит причиной врожденной гиперплазии коры надпочечников .
Преждевременное адренархе нередко является первым маркером ряда метаболических нарушений, приводящих у половозрелых женщин к развитию метаболического синдрома или «Х-синдрома». Основными составляющими этого синдрома у девочек пубертатного периода и у взрослых женщин являются гиперинсулинизм и инсулинорезистентность, дислипидемия, гиперандрогения, гипертензия.
Выраженный вирильный синдром у больных с гипертекозом яичников сочетается с тяжелыми нарушениями менструальной функции по типу олиго- или аменореи (первичной или вторичной), с гиперпластическими процессами эндометрия, с артериальной гипертензией.
Сочетание стромального текоматоза (СТ) с папиллярно-пигментной дистрофией кожи, которая является обычно дерматологическим признаком хронической гиперинсулинемии, лишь подтверждает то, что генетически обусловленная инсулинорезистентность является главным этиологическим фактором в развитии данного состояния .
Появление или усугубление гирсутизма, особенно у больных с олигоменореей и аменореей, может быть обусловлено гиперпролактинемией. Повышенная секреция пролактина напрямую стимулирует стероидогенез в надпочечниках, поэтому у больных с аденомами гипофиза, как правило, существенно увеличено содержание ДЭА и ДЭА-сульфата по сравнению с уровнем тестостерона .
В основе гиперандрогении у больных с нарушением функции щитовидной железы лежит существенное уменьшение продукции ГСПС. Вследствие снижения уровня ГСПС возрастает скорость превращения А в Т. Более того, так как гипотиреоз сопровождается изменением метаболизма ряда ферментативных систем, синтез эстрогенов отклоняется в сторону накопления эстриола (Е3), а не Е2. Накопления Е2 не происходит, и у пациенток развивается клиническая картина преобладающего биологического эффекта Т. По данным С. Йена и Р. Джаффе, у больных с гипотиреозом возможно развитие вторичного поликистоза яичников.
Отдельное место в структуре причин повышенного роста волос на теле у девочек занимает избыточная конверсия Т в его активный метаболит – ДГТ.
Лишь зная источник гиперандрогении, врач может избрать оптимальную тактику ведения больного (таблица 1).
Учитывая многообразие факторов, обуславливающих андрогению и для выбора лечебного воздействия, возможно распределение гиперандрогении на формы: центральную, яичниковую, надпочечниковую, смешанную, периферическую. Устранение гиперандрогении
Аналоги гонадолиберина
Глюкокортикоиды
КОК
Медроксипрогестерон
Применение ингибиторов стероидогенеза -Кетоконазол
При периферической форме гиперандрогении с целью снижения активности 5?-редуктазы и торможения периферических проявлений может быть применен фитопрепарат пермиксон (по 80 мг в сутки) в течение одного месяца с последующим назначением спиронолактона (верошпирон) в дозе 50-100 мг в сутки под контролем активности фермента 5?-редуктазы .
Спиронолактон – антагонист альдостерона, обратимо связывается с его рецепторами в дистальных канальцах. Спиронолактон является калийсберегающим диуретиком и первоначально использовался для лечения артериальной гипертонии. Однако этот препарат обладает целым рядом других свойств, благодаря которым широко применяется при гирсутизме:
1. Блокада внутриклеточного рецептора дигидротестостерона.
2. Подавление синтеза тестостерона.
3. Ускорение метаболизма андрогенов (стимуляция превращения тестостерона в эстрадиол в периферических тканях).
4. Подавление активности 5? – редуктазы кожи.
Спиронолактон статистически значимо снижает уровни общего и свободного тестостерона в сыворотке при синдроме поликистозных яичников. Уровень глобулина, связывающего половые гормоны, не меняется.
Из антиандрогенов следует отметить ципротерон – это прогестаген, производное 17-гидроксипрогестерона, обладающее мощным антиандрогенным действием. Ципротерон обратимо связывается с рецепторами тестостерона и динидротестостерона. Он также индуцирует микросомальные ферменты печени, ускоряя тем самым метоболизм андрогенов. Ципротерон характеризуется слабой глюкокортикоидной активностью и может снижать уровень дегидроэпиандростерона сульфата в сыворотке. В эксперименте показано, что ципротерон может вызывать опухоли печени, поэтому FDA не разрешила его использование в США.
Флутамид – это нестероидный антиандроген, применяемый при раке предстательной железы. Он слабее связывается с рецепторами андрогенов, чем спиронолактон и ципротерон. Назначение в высоких дозах (250 мг внутрь 2-3 раза в сутки) позволяет повысить его эффективность. Флутамид также в некоторой степени угнетает синтез тестостерона. При неэффективности комбинированных ОК добавление флутамида приводит к статистически значимому уменьшению оволосения, снижению уровней андростендиона, дигидротестостерона. ЛГ и ФСГ.
У больных с центральными механизмами наиболее эффективно применение препаратов, оказывающих регулирующее и корригирующее действие на функцию ГГС.
Лечение следует начинать с ликвидации метаболических нарушений. Необходимы профилактические мероприятия, направленные на формирование здорового образа жизни. Возможно назначение препаратов нейромедиаторного и ноотропного действия, витаминных и минеральных комплексов, а также воздействие физическими факторами, направленными на нормализацию функции подкорковых структур.
У больных с предрасположенностью к инсулино-резистентности, положительный клинический эффект оказывают препараты, способные повышать чувствительность тканей к инсулину. Применение с этой целью бигуанидов (метформин, буформин и др.) значительно улучшает чувствительность тканей к данному гормону. Большие надежды возлагаются на сравнительно новую группу препаратов, относящихся к классу тиазолидин-дионов - троглитазон, ниглитазон, пиоглитазон, энглитазон.
При выявлении первичного гипотиреоза, как причины гиперандрогении, патогенетически оправданным является назначение заместительной терапии тиреоидными гормонами. Применяют L-тироксин, доза которого подбирается с учетом клинических и лабораторных данных.
При выявлении гиперпролактинемии у девочек с нарушенным ритмом менструаций и гирсутизмом показано применение допаминомиметиков (Бромокриптин) с индивидуальным подбором дозы с учетом уровня пролактина.
Девочкам с надпочечниковой формой гиперандрогении патогенетически обосновано назначение заместительной терапии глюкокортикоидами в зависимости от степени недостаточности 21-гидроксилазы.
У пациенток с яичниковой формой андрогении понижение концентрации андрогенов в крови может быть достигнуто параллельным применением токоферола ацетата (витамина Е) и кломифена.
В соответствии с патогенезом заболевания, более оправданным является применение комбинированных оральных контрацептивов (КОК). Этинилэстрадиол в комбинации с прогестагеном повышает синтез ГСПС в клетках печени, снижает секрецию яичниками Т и А, а надпочечниками - ДЭА и А.
Таким образом, можно выделить следующие механизмы благоприятного действия КОК:
1. Прогестаген, входящий в состав КОК, подавляет секрецию ЛГ, способствуя тем самым снижению синтеза андрогенов в яичниках.
2. Эстроген, входящий в состав КОК, стимулирует синтез глобулина, связывающего половые гормоны, что способствует снижению уровня свободного тестостерона в сыворотке.
3. Эстрогенный компонент ингибирует 5?-редуктазу кожи, нарушая тем самым превращение тестостерона в дигидротестостерон.
4. КОК снижают секрецию андрогенов корой надпочечников.
Минимальными андрогенными свойствами, но выраженной антиандрогенной активностью обладает дезогестрел. Дезогестрел является производным 19-нортестостерона, содержащего в положении С11 метильную группу, благодаря наличию которой блокируется связывание гормона с андрогенными рецепторами. Способность дезогестрела избирательно блокировать только прогестероновые рецепторы (высокая селективность) и, тем самым, оставлять свободными эстрогеновые рецепторы, обусловила улучшение эстрогенных эффектов этинилэстрадиола на органы-мишени. В комбинации с этинилэстрадиолом (даже при дозе в 20 мкг) дезогестрел сохраняет вызываемое эстрогенами биологическое действие.
Важно отметить, что КОК, содержащие дезогестрел, следует назначать по контрацептивной схеме не менее чем на 6-9 месяцев. Проявления таких признаков андрогении, как акне и себорея, уменьшаются через 2-3 месяца приема КОК последнего поколения Регулона, а выраженность гирсутизма - через 12 месяцев
Преимущества низко- и микродозированных КОК (Регулон и Новинет) заключаются:
в снижении риска эстрогенозависимых побочных эффектов (тошнота, задержка жидкости, нагрубание молочных желез, головная боль),
в отсутствии клинически значимого влияния на свертываемость крови,
в возможности применять их в соответствии с критериями приемлемости ВОЗ, начиная с менархе.
Гиперандрогения яичникового происхождения
1. Синдром поликистозных яичников (синдром Штейна-Левенталя)
а. Общие сведения. Этот синдром обнаруживают у 3-6% женщин детородного возраста. Причины синдрома многообразны, но во всех случаях главным звеном патогенеза является первичное или вторичное нарушение регуляции в гипоталамо-гипофизарной системе, которое приводит к усилению секреции ЛГ или к увеличению отношения ЛГ/ФСГ. Относительный или абсолютный избыток ЛГ вызывает гиперплазию внешней оболочки и гранулярного слоя фолликулов и гиперплазию стромы яичников. В результате усиливается секреция яичниковых андрогенов и появляются симптомы вирилизации. Из-за относительного дефицита ФСГ нарушается созревание фолликулов, что приводит к ановуляции.
б. Этиология
1) Предполагают, что относительный или абсолютный избыток ЛГ может быть обусловлен первичным заболеванием гипоталамуса или аденогипофиза, однако четких доказательств этой гипотезы нет.
2) Пусковым фактором патогенеза может служить избыток надпочечниковых андрогенов в период адренархе. В периферических тканях надпочечниковые андрогены превращаются в эстрон, который стимулирует секрецию ЛГ (по принципу положительной обратной связи) и подавляет секрецию ФСГ (по принципу отрицательной обратной связи). ЛГ вызывает гиперсекрецию андрогенов в яичниках, избыток яичниковых андрогенов превращается в периферических тканях в эстрон, и порочный круг замыкается. В дальнейшем надпочечниковые андрогены уже не играют существенной роли в стимуляции секреции ЛГ.
5) Избыток андрогенов может быть обусловлен нарушениями стероидогенеза в яичниках. Так, у некоторых больных повышена активность 17альфа-гидроксилазы. Этот фермент превращает 17-гидроксипрегненолон в дегидроэпиандростерон и 17-гидроксипрогестерон в андростендион. Другая причина заболевания - недостаточность 17бета-гидроксистероиддегидрогеназы, которая превращает андростендион в тестостерон и эстрон в эстрадиол.
6) Нередко синдром поликистозных яичников развивается при первичном гипотиреозе. Снижение уровня T4 усиливает секрецию тиролиберина. Тиролиберин стимулирует синтез не только ТТГ, но и альфа-субъединиц ЛГ и ФСГ (структура альфа-субъединиц ТТГ, ЛГ и ФСГ идентична). Повышение концентрации альфа-субъединиц в гонадотропных клетках аденогипофиза стимулирует синтез соответствующих бета-субъединиц. В результате повышается уровень гормонально-активного ЛГ.
3. Обследование
а. Анамнез и физикальное исследование. Исключают заболевания, сопровождающиеся гиперандрогенией: гипотиреоз, гиперпролактинемию, гипофизарный синдром Кушинга, акромегалию, заболевания печени, нарушения половой дифференцировки, андрогенсекретирующие опухоли надпочечников.
1) Базальные уровни гормонов. Определяют содержание общего и свободного тестостерона, андростендиона, дегидроэпиандростерона сульфата, ЛГ, ФСГ и пролактина в сыворотке. Кровь берут натощак. Поскольку уровни гормонов непостоянны (особенно у больных с яичниковой недостаточностью), берут 3 пробы с интервалом 30 мин и смешивают их. Определяют также содержание 17-кетостероидов в моче.
Уровни андростендиона и тестостерона, как правило, повышены. Отношение ЛГ/ФСГ > 3. Уровень дегидроэпиандростерона сульфата (андрогена, секретируемого преимущественно надпочечниками) нормальный. Содержание 17-кетостероидов в моче также в пределах нормы. Если содержание общего тестостерона > 200 нг%, следует заподозрить андрогенсекретирующую опухоль яичников или надпочечников. Уровень дегидроэпиандростерона сульфата, превышающий 800 мкг%, указывает на андрогенсекретирующую опухоль надпочечников.
2) Пробу с ХГ (см. гл. 19, п. II.А.6) проводят, если при наличии симптомов гиперандрогении не удалось выявить повышение базальных уровней андрогенов. При гиперандрогении яичникового происхождения секреторная реакция яичников на ХГ усилена.
в. Инструментальные исследования. Для визуализации опухолей надпочечников применяют КТ и МРТ, а для выявления опухолей яичников - УЗИ, лучше с влагалищным датчиком. Если опухоль не удалось локализовать этими методами, проводят чрескожную катетеризацию надпочечниковых и яичниковых вен и берут кровь для определения гормонов.
б. Если восстановление фертильности не входит в план лечения, то назначают какой-либо комбинированный пероральный контрацептив, содержащий не более 0,05 мг этинилэстрадиола. Если гиперандрогения вызвана избытком ЛГ, то через 1-2 мес приема комбинированных пероральных контрацептивов уровни тестостерона и андростендиона нормализуются. Противопоказания к назначению пероральных контрацептивов обычные.
в. Если комбинированные пероральные контрацептивы противопоказаны, назначают спиронолактон, 100 мг/сут внутрь до 1-го дня следующего менструального цикла, затем делают перерыв и возобновляют прием препарата на 8-й день менструального цикла. Лечение проводят в течение 3-6 мес. При необходимости дозу спиронолактона постепенно увеличивают до 400 мг/сут.
Б. Гиперандрогения смешанного (яичникового и надпочечникового) происхождения
1. Этиология и патогенез. Гиперандрогения смешанного происхождения может быть обусловлена генетическим дефектом 3бета-гидроксистероиддегидрогеназы (см. рис. 21.4, а также гл. 15, п. III.Б). Этот ферментный комплекс имеется в яичниках, надпочечниках и периферических тканях и превращает дегидроэпиандростерон в андростендион, прегненолон - в прогестерон и 17-гидроксипрегненолон - в 17-гидроксипрогестерон. Клинические проявления недостаточности 3бета-гидроксистероиддегидрогеназы обусловлены накоплением дегидроэпиандростерона - слабого андрогена. Умеренное повышение уровня тестостерона в сыворотке обусловлено его образованием в периферических тканях (в этих тканях дефект 3бета-гидроксистероиддегидрогеназы не проявляется).
2. Лабораторная диагностика. Повышены уровни прегненолона, 17-гидроксипрегненолона и дегидроэпиандростерона сульфата, т. е. предшественников минералокортикоидов, глюкокортикоидов и андрогенов соответственно. Эффективность лечения оценивают по уровню дегидроэпиандростерона сульфата.
3. Лечение
а. Цель лечения - снизить уровень дегидроэпиандростерона сульфата в сыворотке до нормы (100-200 мкг%). Если женщина хочет иметь детей, назначают малые дозы дексаметазона. Он подавляет синтез дегидроэпиандростерона и дегидроэпиандростерона сульфата в надпочечниках. Начальная доза дексаметазона - 0,25 мг/сут на ночь. Обычно уровень дегидроэпиандростерона сульфата нормализуется через месяц.
б. Во время лечения уровень кортизола в сыворотке должен быть равен 3-5 мкг% (не выше). У некоторых больных даже при низких дозах дексаметазона быстро развивается синдром Кушинга, поэтому дозу подбирают индивидуально и проводят ежемесячные обследования. Некоторые эндокринологи назначают очень низкие дозы дексаметазона, например 0,125 мг 3 раза в неделю на ночь.
в. Через год дексаметазон отменяют и обследуют больную. Безуспешность лечения дексаметазоном говорит о том, что значительные количества андрогенов секретируются яичниками, а не надпочечниками. В таких случаях назначают комбинированные пероральные контрацептивы в малых дозах.
В. Первичная надпочечниковая и вторичная яичниковая гиперандрогения
1. Этиология и патогенез. Первичная надпочечниковая андрогения наблюдается при неклассических формах врожденной гиперплазии коры надпочечников, в частности - при недостаточности 21-гидроксилазы или 11бета-гидроксилазы. Надпочечники секретируют значительные количества андростендиона, который превращается в эстрон. Эстрон по принципу положительной обратной связи стимулирует секрецию ЛГ. В результате развивается синдром поликистозных яичников.
2. Лабораторная диагностика. Повышены уровни тестостерона и андростендиона в сыворотке. Для подтверждения диагноза проводят короткую пробу с АКТГ. Синтетический аналог АКТГ тетракозактид вводят в/в или в/м в дозе 0,25 мг. Через 30 и 60 мин измеряют уровни 11-дезоксикортизола и 17-гидроксипрогестерона в сыворотке. Результаты сравнивают с показателями, полученными при обследовании больных с классическими и неклассическими формами недостаточности 21-гидроксилазы или 11бета-гидроксилазы. При классических формах недостаточности 21-гидроксилазы и 11бета-гидроксилазы обычно наблюдается значительное повышение концентрации 17-гидроксипрогестерона или 11-дезоксикортизола соответственно. При неклассических формах уровни этих метаболитов повышаются в меньшей степени.
3. Лечение. Назначают дексаметазон в дозе 0,25 мг/сут на ночь (см. гл. 21, п. III.Б.3.а).
Г. Надпочечниковая гиперандрогения и яичниковая недостаточность
1. Этиология и патогенез. Гиперандрогения в сочетании с вторичной яичниковой недостаточностью наблюдается при гиперпролактинемии. Нередкая причина гиперпролактинемии - аденома гипофиза. Причины гиперпролактинемии перечислены в табл. 6.6. Пролактин стимулирует секрецию андрогенов в надпочечниках и одновременно подавляет секрецию гонадотропных гормонов.
2. Диагностика. При гиперпролактинемии снижены уровни тестостерона и дигидротестостерона. Уровень дегидроэпиандростерона сульфата повышен.
3. Лечение гиперпролактинемии устраняет гиперандрогению и нормализует функцию яичников.
Антиандрогенные препараты: cовременная терапия акне у женщин
Андрогены в физиологии женского организма
Несмотря на то что роли андрогенов в физиологии женского организма по сравнению с эстрогенами и прогестероном уделяется меньшее внимание, их влияние на функционирование практически всех систем организма и участие в развитии многих патологических состояний весьма существенно и разнообразно.
Связываясь с рецепторами лимбической системы головного мозга, андрогены формируют либидо, инициативность в поступках, агрессивность в поведении. Под действием андрогенов происходит линейный рост и закрытие эпифизов в трубчатых костях. В костном мозге андрогены стимулируют митотическую активность стволовых клеток, в почках – продукцию эритропоэтина, в печени – белков крови. Увеличение мышечной массы, рост волос, функционирование апокриновых и сальных желез являются андрогензависимыми процессами .
Синтез половых стероидов в организме женщины можно представить следующим образом. В ответ на стимуляцию лютеинизирующим гормоном (ЛГ) гипофиза яичника в его текаклетках из холестерина образуются андрогены – андростендион (основной андроген яичников) и тестостерон, которые под действием фолликулостимулирующего гормона (ФСГ) подвергаются ароматизации в эстрогены – эстрон и эстрадиол в клетках гранулезы яичников. Возрастающее количество эстрадиола по механизму отрицательной обратной связи ведет к уменьшению выброса ФСГ, а по механизму положительной обратной связи – к повышению продукции ЛГ. Последний стимулирует продукцию андрогенов текаклетками, большая часть тестостерона под действием фермента 5a-редуктаза I типа переходит в самый активный метаболит – дигидротестостерон (рис. 1, а), который не ароматизируется в эстроген и вызывает овуляцию с последующим формированием желтого тела, продуцирующего прогестерон.
Определенный вклад в синтез андрогенов в женском организме вносит корковый слой надпочечников. В его сетчатой зоне синтезируется основной предшественник андрогенов – дегидроэпиандростерон, который после изомеризации в андростендион восстанавливается в тестостерон. Половые стероиды надпочечника являются промежуточным звеном синтеза глюкокортикоидов и минералокортикоидов. В надпочечниках образуется также до 90% дегидроэпиандростендиона и 100% дегидроэпиандростендиона сульфата, которые являются предшественниками тестостерона. Продукция андрогенов в надпочечниках заметно возрастает, если нарушается биосинтез глюкокортикоидов из-за недостаточности одной из гидроксилаз (адреногенитальный синдром). Гиперандрогения гонадного происхождения возможна при избыточной стимуляции гонад ЛГ, при опухолевом перерождении текаклеток или в случаях недостаточности фермента 17-ОН-дегидрогеназы, катализирующей переход тестостерона в эстрадиол.
Яичники, надпочечники и периферические ткани (в основном кожа и жировая ткань) вносят свой вклад в продукцию андрогенов в организме женщины. Примерно 25% суточного количества тестостерона образуется в яичниках, 25% – в надпочечниках и 50% – путем конверсии из андростендиона в периферических тканях. В суточную продукцию андростендиона яичники и надпочечники вносят примерно одинаковый вклад. В первую фазу менструального цикла продукция андрогенов надпочечниками превышает таковую яичников. По мере созревания фолликула основным органом продукции андрогенов становятся яичники.
Основная часть тестостерона, циркулирующего в крови (около 80%), находится в связанном состоянии с секс-гормонсвязывающим глобулином (СГСГ), примерно 19% – в связанном состоянии с альбумином и только 1% циркулирует в свободном состоянии. Биологически активным является свободный и связанный с альбумином тестостерон.
Гиперандрогения
Гиперандрогения – одна из наиболее частых причин хронической ановуляции (35%) и как следствие – бесплодия. В дерматологии гиперандрогения является этиологическим звеном патогенеза акне, себореи и гирсутизма. В патогенезе акне ведущее значение отводится четырем факторам. Инициальным звеном является наследственно обусловленная гиперандрогения. Это состояние может проявляться в виде абсолютного увеличения количества гормонов (абсолютная гиперандрогения) или в виде повышенной чувствительности рецепторов к нормальному или сниженному количеству андрогенов в организме (относительная гиперандрогения) .
К патологическим состояниям, приводящим к абсолютной гиперандрогении, относят:
1. Синдром поликистозных яичников (центрального или яичникового генеза).
2. Гипертекоз яичников (увеличение количества или активности текаклеток).
3. Андрогенпродуцирующие опухоли яичников или надпочечников.
4. Адреногенитальный синдром (врожденная гиперплазия коры надпочечников).
5. Болезнь или синдром Кушинга.
6. Нарушение жирового обмена.
7. Сахарный диабет типа 2.
8. Гиперпролактинемия.
9. Гипер- или гипотиреоз.
10. Прием препаратов, обладающих андрогенной активностью.
Наиболее часто встречаются состояния относительной гиперандрогении. В клетках сальных желез – себоцитах – тестостерон под действием фермента 5a-редуктазы I типа переходит в самый активный метаболит – дигидротестостерон, который является непосредственным стимулятором роста и созревания себоцитов, образования кожного сала. Основными причинами относительной гиперандрогении являются:
1. Повышенная активность фермента 5a-редуктазы I типа.
2. Повышенная плотность ядерных дигидротестостерон-рецепторов.
3. Увеличение свободной фракции тестостерона в крови как результат уменьшения синтеза СГСГ в печени.
Таким образом, в патогенезе акне ведущая роль принадлежит гормональному фактору, приводящему к гипертрофии и повышенному функционированию сальных желез, фолликулярному гиперкератозу в протоке сально-волосяного фолликула, активации микроорганизмов с последующим воспалением.
Большинство женщин отмечают обострение акне во второй половине менструального цикла. Это объясняется антагонистическим действием эстрогенов и прогестерона на ренин-ангиотензин-альдостероновую систему, что приводит к задержке натрия и воды в организме. В коже перифолликулярный отек способствует сужению протока сально-волосяного фолликула и обострению акне.
Препараты с антиандрогенной активностью
Исходя из основ этиопатогенеза акне, для лечения этого заболевания у женщин адекватными и патогенетически обоснованными должны являться вещества, оказывающее супрессивное действие на состояние гиперандрогении, т.е. антиандрогены.
Среди препаратов, влияющих на выраженность андрогенизации, наиболее широко применяемыми являются комбинированные оральные контрацептивы (КОК). Все КОК состоят из этинилэстрадиола и гестагенного компонента. По количеству этинилэстрадиола все КОК делятся на высокодозированные (50 мкг/сут), низкодозированные (30–35 мкг/сут) и микродозированные (15–20 мкг/сут). Синтетические гестагены (прогестагены, прогестины), входящие в состав КОК, относятся к производным:
1. Тестостерона (19-норстероиды):
а) содержащие этинильную группу (I, II, III поколения);
б) не содержащие этинильную группу (диеногест).
2. Прогестерона (ципротеронацетат и др.).
3. Спиронолактона (дроспиренон).
Наиболее важным эффектом КОК является контрацептивный в виде подавления овуляции по механизму отрицательной обратной связи (блокируя выброс рилизинг-гормонов гипоталамуса и гонадотропных гормонов передней доли гипофиза – ФСГ и ЛГ). Поскольку экзогенно вводимые этинилэстрадиол и гестаген подавляют эндогенную выработку гормонов, их биологические влияния на гормонозависимые структуры должны максимально приближаться к действию эндогенного эстрогена и прогестерона. Однако если фармакодинамические характеристики этинилэстрадиола максимально приближены к эстрадиолу, то гестагены (в зависимости от структуры) проявляют как свойства прогестерона, так и другие фармакологические эффекты.
К желаемым действиям этинилэстрадиола относят: антигонадотропное (потенцирование действия гестагенов), пролиферацию эндометрия и стимуляцию синтеза белков в печени (транспортные молекулы, в частности СГСГ, факторы свертывания крови, апобелки липопротеидов высокой плотности). К побочным эффектам относят активацию ренин-ангиотензин-альдостероновой системы с последующей задержкой натрия и воды в организме.
Основным действием синтетических гестагенов является их гестагенная активность, которая заключается в антигонадотропном действии, секреторной трансформации эндометрия и поддержании беременности. Антиэстрогенный эффект заключается в уменьшении количества эстрогеновых рецепторов в органах-мишенях.
Наиболее неблагоприятным побочным действием гестагенов – производных 19-норстероидов, содержащих этинильную группу, является остаточная андрогенная активность, которая проявляется в появлении акне, повышении атерогенности плазмы крови, ухудшении толерантности к глюкозе и анаболитическом эффекте.
К механизмам остаточной андрогенной активности гестагенов относятся:
1. Стимуляция андроген-рецепторов из-за структурного сходства с дигидротестостероном.
2. Вытеснение тестостерона из связи с СГСГ, так как синтетические гестагены обладают бЧльшим сродством к этому транспортному белку, чем тестостерон (повышение уровня свободного тестостерона).
3. Угнетение синтеза СГСГ в печени (повышение уровня свободного тестостерона).
С учетом противоугревого действия в дерматологической практике предпочтение среди КОК отдается монофазным низкодозированным препаратам, содержащим гестаген с антиандрогенной активностью. Этим требованиям отвечают препараты “Диане-35” (0,035 мг этинилэстрадиола и 2 мг ципротеронацетата), “Жанин” (0,03 мг этинилэстрадиола и 2 мг диеногеста) и “Ярина” (0,03 мг этинилэстрадиола и 3 мг дроспиренона), выпускаемые компанией “Schering” (Германия) и зарегистрированные в России.
Первым КОК с антиандрогенным действием был препарат “Диане-50”, созданный на основе синтезированного Ф. Ньюманом в 1961 г. ципротерона ацетата. В 1985 г. компанией “Schering” (Германия) были созданы “Диане-35” и препарат “Андрокур” (10 или 50 мг ципротеронацетата). Благодаря уникальным свойствам ципротеронацетата “Диане-35” обладает многоуровневым антиандрогенным действием (см. рис. 2). Совместно с этинилэстрадиолом ципротеронацетат, блокируя выброс ЛГ гипофизом, подавляет продукцию андрогенов в яичниках. В крови ципротеронацетат связывается с альбумином и не вытесняет тестостерон из связи с СГСГ. Кроме того, ципротеронацетат потенцирует действие этинилэстрадиола, направленное на стимуляцию синтеза СГСГ печенью (снижение уровня свободного тестостерона в плазме крови). Самым важным свойством ципротеронацетата является прямое антиандрогенное действие за счет блокады периферических андроген-рецепторов и препятствие связыванию с ними дигидротестостерона. В органах-мишенях ципротеронацетат подавляет активность фермента 5a-редуктазы I типа (блокада образования дигидротестостерона из тестостерона). Благодаря периферическому действию “Диане-35” подавляет активность не только андрогенов, синтезированных в яичниках, но и образующихся в надпочечниках, жировой ткани и коже.
Показаниями к назначению “Диане-35” при акне являются состояния как относительной, так и абсолютной гиперандрогении (синдром поликистозных яичников, врожденная гиперплазия коры надпочечников, синдром и болезнь Кушинга).
Лечение гирсутизма в отличие от акне является более длительным процессом и требует от 6 до 24 мес. Для повышения эффективности лечения рекомендуется сочетание “Диане-35” с препаратом “Андрокур”: “Диане-35” начинают принимать в 1-й день менструального цикла в течение 21 дня с 7-дневным перерывом. Дополнительно в течение 15 дней первой фазы цикла назначают “Андрокур” в суточной дозе 10–50 мг до достижения терапевтического эффекта (“обратный циклический режим”), затем переходят на монотерапию “Диане-35”.
В 1995 г. появился новый КОК, который помимо 0,03 мг этинилэстрадиола содержит 2 мг диеногеста, обладающего свойствами группы 19-норстероидов (гестагенная активность) и производных прогестерона (антиандрогенная активность). В России препарат зарегистрирован под названием “Жанин”. Фармакологические свойства диеногеста во многом сходны с действием естественного прогестерона (высокая селективность при связывании с прогестероновыми рецепторами, отсутствие отрицательного воздействия на метаболизм). Гестагенная активность диеногеста проявляется преимущественно периферическим действием (сильное влияние на эндометрий и яичники при умеренной антигонадотропной активности). В отличие от гестагенов – производных 19-норстероидов, содержащих этинильную группу в положении С17, диеногест не оказывает влияния на активность цитохрома Р-450 и не нарушает метаболизма в печени.
Основное антиандрогенное действие препарата “Жанин” состоит в подавлении синтеза андрогенов в яичниках и инактивации фермента 5a-редуктазы I типа в коже. В крови диеногест связывается с альбумином и не вытесняет тестостерон из связи с СГСГ. Кроме того, диеногест потенцирует действие этинилэстрадиола, направленное на стимуляцию синтеза СГСГ печенью (снижение уровня свободного тестостерона в плазме). Вместе с тем диеногест практически не оказывает влияния на секрецию гонадотропинов.
В конце 90-х годов ХХ века был синтезирован гестаген дроспиренон, являющийся производным спиронолактона. Спиронолактон (в России – верошпирон, “Gedeon Richter”, Венгрия), являясь препаратом с антиминералокортикоидным действием, оказывает антиандрогенное действие за счет блокады периферических андроген-рецепторов (способность дроспиренона блокировать андроген-рецепторы несколько ниже, чем у ципротеронацетата). За рубежом спиронолактон зарегистрирован в качестве антиандрогенного препарата в суточной дозировке 200 мг у женщин старше 30 лет. Однако спиронолактон вызывает нарушения менструального цикла, что диктует необходимость его назначения при акне в комбинации с КОК.
Созданный на основе 0,03 мг этинилэстрадиола и 3 мг дроспиренона КОК “Ярина” (в Европе – “Yasmin”, Schering, Германия) позволил достичь контрацептивного и противоугревого эффекта и избежать развития побочных явлений, которые наблюдаются при использовании препаратов на основе спиронолактона. Противоугревая активность “Ярина” обусловлена его прямым (блокада дроспиреноном андроген-рецепторов) и непрямым (антигонадотропная активность, стимуляция этинилэстрадиолом и дроспиреноном синтеза СГСГ печенью, отсутствие вытеснения тестостерона из связи с СГСГ, так как дроспиренон переносится кровью в связанном виде с альбуминами) антиандрогенным действием, а также подавляющим действием на ренин-ангиотензин-альдостероновую систему – блокада дроспиреноном альдостероновых рецепторов (рис. 1, в). Последнее свойство препарата “Ярина” является очень важным, особенно у женщин, отмечающих обострение акне во второй половине цикла (обострение акне за счет перифолликулярного отека) и увеличение массы тела за счет задержки жидкости (см. рис. 2). Кроме того, показанием к применению препарата являются проявления предменструального синдрома (циклически возникающие психологические, поведенческие и физиологические симптомы, связанные также с задержкой натрия и воды в организме). Задержка натрия и воды во второй половине цикла обусловлена активацией ренин-ангиотензин-альдостероновой системы эстрадиолом, прогестероном и этинилэстрадиолом, входящим в состав КОК.
Двойные слепые рандомизированные исследования, проводимые за рубежом по выявлению эффективности и безопасности “Yasmin” в сравнении с другими КОК, показали, что помимо надежного контрацептивного эффекта “Yasmin” оказывает противоугревое действие и способствует снижению массы тела (за счет антиминералокортикоидного эффекта) в среднем на 1–2 кг за 6 мес лечения. В группах женщин, получавших КОК сравнения, отмечалось некоторое увеличение массы тела.
Целью нашей работы явилась оценка противоугревой эффективности и переносимости КОК с антиандрогенной активностью у женщин с различной тяжестью акне и соответственно разработка критериев выбора метода терапии в зависимости от тяжести кожного поражения.
Материал и методы
Мы исследовали противоугревое действие КОК “Диане-35”, “Жанин” и “Ярина” у 86 женщин с акне II–III степени тяжести в возрасте от 16 до 37 лет.
За основу оценки тяжести акне была взята классификация, предложенная Американской академией дерматологии (в нашей модификации):
I степень характеризуется наличием комедонов (открытых и закрытых) и до 10 папул;
II степень – комедоны, папулы, до 5 пустул;
III степень – комедоны, папулопустулезная сыпь, до 5 узлов;
IV степень отличается выраженной воспалительной реакцией в глубоких слоях дермы с формированием множественных болезненных узлов и кист.
Первую группу наблюдения (разделенную затем на 2 подгруппы) составили 68 женщин в возрасте от 16 до 37 лет с акне II или III степени тяжести и локализацией процесса на лице и туловище, получавших на протяжении 6 мес противоугревую терапию КОК. В каждую подгруппу вошли 22 женщины с III и 12 женщин со II степенью тяжести акне. Первая подгруппа женщин получала терапию “Диане-35”, вторая подгруппа – “Жанин”.
Вторую группу наблюдения составили 18 женщин в возрасте от 19 до 34 лет с акне II–III степени тяжести, которые отмечали обострение акне во второй половине цикла. В течение 6 мес пациентки получали противоугревую терапию препаратом “Ярина”.
Каждый из трех препаратов назначали в течение 6 мес по стандартной схеме: все женщины перед началом приема КОК в 1-й день менструального кровотечения делали HCG-тест (humane chorionic gonadotropin – человеческий хорионический гонадотропин) с утренней мочой и при отрицательном результате принимали первую таблетку препарата. В течение последующих 20 дней препарат принимали примерно в одно и то же время суток. Прием каждой следующей упаковки начинали после 7-дневного перерыва, во время которого наблюдалось менструальноподобное кровотечение отмены.
Динамику количества открытых и закрытых комедонов, папул, пустул оценивали до начала терапии, спустя 3 и 6 мес. В указанные сроки наряду с подсчетом акне-элементов проводили процедуру определения уровня секреции кожного сала (УСКС) при помощи прибора “Sebumeter SM 810” (“Courage+Khazaka electronic GmbH”, Германия). Принцип действия прибора основан на количественном определении кожного сала методом фотометрии. Нормальный УСКС составляет 60–90ґ10-6 г/см2.
У всех женщин до начала лечения анализировали гинекологический анамнез (возраст менархе, число родов, абортов), оценивали менструальную функцию на протяжении последних 6 мес (эпизоды аменореи, дисменореи, межциклические выделения), производили осмотр молочных желез и гениталий. По окончании терапии гинекологический осмотр повторяли.
Всем женщинам до начала терапии и по ее окончании проводили цитологическое исследование эпителия влагалищной части шейки матки для исключения морфологических признаков, характеризующих диспластические процессы (мазок по Папаниколау). Результаты оценивали по 5-балльной шкале: 1 – норма, 2 – легкая дисплазия, 3 – умеренная дисплазия, 4 – тяжелая дисплазия, 5 – рак in situ
Критериями исключения для приема КОК являлись: наличие тромбозов в настоящее время или в анамнезе; сахарный диабет с сосудистыми осложнениями; тяжелые поражения печени различного генеза (в том числе опухоли); гормонозависимые злокачественные заболевания половых органов и молочных желез или подозрение на них; эндометриоз различной локализации; вагинальные кровотечения неясного генеза; беременность и грудное вскармливание; повышенная чувствительность к любому из компонентов препарата; возраст старше 35 лет (для курящих более 10 сигарет в день – 30 лет); отсутствие влияния на акне какого-либо КОК, принимавшегося ранее с контрацептивной или лечебной целью.
Причины и последствия гиперандрогении у женщин
Как бы ни странно это прозвучало, но каждый день в женском организме вырабатывается определенная порция не только женских, а и мужских гормонов (андрогенов). Хотя андрогены и считают мужскими гормонами, но обойтись без них женщина так же не может. Они выполняют много важных функций – отвечают за рост и состояние костей, мышц и жировой ткани, влияют на половое влечение женщины, контролируют работу и состояние сальных желез, кожи, рост волос, принимают участие во многих жизненно важных биохимических процессах.
Правда, в женском организме производится андрогенов примерно в 25 раз меньше. Этого количество полностью хватает, чтобы контролировать вышеуказанные процессы и при этом сохранять женственность. Если по каким либо причинам количество мужских гормональных веществ начинает расти, то развивается состояние гиперандрогении с соответствующими симптомами и последствиями для женщины, которые мы рассмотрим ниже.
Гиперандрогения у женщин: что это такое?
У женщин за продукцию андрогенов отвечают яичники, кора надпочечниковых желез, а также периферические ткани. Ежедневно эндокринной системой женщины вырабатывается 250-300 мкг андрогенов (у мужчин примерно 6000 мкг). Если этот показатель увеличивается, то можно говорить о состоянии гиперандрогении.
Женская гиперандрогения – это не отдельная болезнь, а клинико-лабораторный синдром, который может встречаться при нескольких патологических состояниях. Гиперандрогения вызывает вирилизацию – появление у женщин вторичных половых признаков мужчины (оволосение лица, живота, груди, снижение голосового тембра, алопеция височных зон головы, потеря женских форм тела), а также развитие акне, аменореи и бесплодия. Наряду с этими признаками развивается еще много патологических симптомов, по которым можно заподозрить гиперандрогению.
Причины гиперандрогении у женщин
Рассматривая причины повышения уровня мужских гормонов у женщин, их можно поделить на две основные категории:
- Вирилизация яичникового генеза.
- Вирилизация надпочечникового генеза.
Патология яичников и гиперандрогения
Синдром поликистозных яичников
Данную патологию также именуют синдромом Штейна-Левенталя. Представляет собой изменение структуры (формирование множественных кистозных образований) и функции половых желез на фоне нейроэндокринных нарушений. Патология сопровождается гиперандрогенией с соответствующими симптомами, нарушением менструальной функции вплоть до аменореи, торможением процесса фолликулогенеза в яичниках и овуляции (развивается ановуляция), ожирением, повышенным ростом волос и бесплодием.
Андрогеносекретирующие опухоли яичников
Среди опухолевых образований женских половых желез такие гормонопродуцирующие новообразования занимают 3%. Чаще всего – это текома, лютеома, опухоль Сертоли-Лайдига, опухоль Лайдига, гранулематозные образования. Они, как правило, небольшого размера, но быстро приводят к развитию и прогрессированию вирилизации и гирсутизму (повышенный рост волос). Данные опухоли имеют большой канцерогенный потенциал – перерождаются в злокачественные образования в 20-30% случаев. Лечение только хирургическое.
Синдромы гиперплазии яичников
К гиперандрогении приводят гипертекоз и стромальная гиперплазия яичников. Именно в этих структурах женских половых желез находятся эндокринные клетки, которые отвечают за образование андрогенов. Соответственно, при их гиперплазии развивается гиперандрогения и вирилизация женщины. В большинстве случаев такая патология наблюдается у старших женщин. Наряду с вирильными симптомами можно наблюдать повышение давления, ожирение, развитие диабета 2 типа, онкозаболевания матки.
Патология надпочечников и гиперандрогения
Адреногенитальный синдром
Это заболевание еще называют врожденной гиперплазией коркового вещества надпочечников. При этой патологии в организме наблюдается врожденный дефицит энзима 21-гидроксилазы или некоторых других, которые принимают участие в синтезе гормона кортизола. В патологических условиях количество продукции кортизола уменьшается, что приводит за принципом обратной связи к гиперпродукции АКТГ гормона гипофиза. Данное вещество стимулирует образование андрогенов в коре надпочечников, что приводит к их повышению в крови женщины. Основные симптомы заключаются в вирилизации, нарушении менструаций, отсутствии овуляции и бесплодии, нарушениях полового развития.
Синдром Иценко-Кушинга
Данное заболевание характеризируется повышенной продукцией гормонов надпочечников, в том числе и андрогенов, из-за повышенного количества АКТГ гормона гипофиза (аденома гипофиза, гормонопродуцирующая опухоль другой локализации, например, АКТГ-продуцирующее новообразование легких и пр.). Вместе с симптомами вирилизации наблюдается повышение артериального давление, ожирение верхней части тела, стрии на животе, груди, бедрах, сахарный диабет, остеопороз, нарушение менструаций и бесплодие.
Гормонопродуцирующие опухоли надпочечников
Встречаются, как доброкачественные (аденома), так и злокачественные (карцинома) опухоли надпочечников, которые синтезируют андрогены. Характерно быстрое развитие симптомов гиперандрогении наряду с объемным образованием в проекции надпочечников по данным УЗИ, КТ и МРТ.
Какие симптомы и признаки гиперандрогении у женщин?
Клиническая картина гиперандрогении у женщин в первую очередь зависит от причины и нозологической формы заболевания. Все симптомы можно разделить на 3 группы:
- Косметический дефект – угревая болезнь, себорея, облысение (чаще по мужскому типу – на височных участках головы), гирсутизм (повышенный рост волос и оволосение по мужскому типу – на лице, груди, животе, бедрах, ареолах сосков).
- Гинекологические нарушения – патология менструального цикла, аменорея, ановуляция, гиперплазия эндометрия (маточные кровотечения), бесплодие, СПКЯ.
- Нарушение обменных процессов в организме – развитие инсулинорезистентности, сахарного диабета 2 типа, ожирения, повышение количества холестерина в крови, артериальная гипертония, остеопороз.
Очень часто гиперандрогения протекает скрыто. О патологии следует задуматься, если у вас не получается забеременеть, по УЗИ у вас диагностирован СПКЯ, вы страдаете от гирсутизма, акне, имеете лишний вес.
Диагностика гиперандрогении у женщин
Диагностика гиперандрогении основана в первую очередь на лабораторном определении уровня андрогенов в крови. Мы считаем нецелесообразным приводить какие-то нормы этих показателей, так как результаты, сделанные различными лабораториями, существенно отличаются. Это зависит от метода определения, типа лабораторного оборудования и реактивов. Каждая лаборатория имеет свои нормы показателей, которые обязательно указываются при выдаче результатов.
Существуют такие состояния, при которых уровень андрогенов в крови нормальный, но симптомы вирилизации присутствуют. В таких случаях можно говорить об идиопатическом гирсутизме. Его связывают с повышенной чувствительностью органов-мишеней (кожа, сальные железы, волосы) к андрогенам. Диагностировать такое состояние трудно и это, как правило, является диагнозом-исключением, когда при полном обследовании не найдено патологии, сопровождающейся вирилизацией женского организма.
Чтобы разобраться, какая именно нозологическая форма вызвала гиперандрогению, используют дополнительные методы обследования в зависимости от предполагаемой болезни: УЗИ, компьютерную и МР-томографию, рентген, лапароскопию, различные лабораторные тесты и провокационные гормональные пробы, учитывают другие сопутствующие признаки и симптомы.
Гиперандрогения у женщин при беременности
Гиперандрогения при беременности – это опасное состояние, которое приводит к самопроизвольным абортам в первом триместре. Очень часто женщинам с диагнозом самопроизвольное прерывание беременности и привычное невынашивание устанавливается диагноз гиперандрогении. Также необходимо отметить, что с таким диагнозом очень трудно забеременеть вообще, но, если степень повышения мужских гормонов не критическая, то это возможно, но такую беременность тяжело сохранить.
Особо опасный период – это первый триместр (до формирования плаценты). Дело в том, что в этот период продукция прогестерона (главного гормона беременности) лежит на желтом теле яичников. В условиях гиперандрогении то небольшое количество прогестерона не может обеспечить необходимые условия для развития эмбриона. После формирования плаценты продукция прогестерона значительно увеличивается, и риск самопроизвольного аборта уменьшается.
Всем беременным с гиперандрогенией назначают специфическую гормональную терапия, которая направленна на подавление мужских половых гормонов и повышения количества прогестерона.
Беременность при синдроме Шерешевского – Тернера
– это врожденная хромосомная патология, которая характеризируется отсутствием одной женской Х-хромосомы в кариотипе (вместо нормальных двух присутствует только одна).
Заболевание характеризируется специфическим фенотипом и диагностируется, как правило, на первых годах жизни ребенка. Больные девочки отстают в физическом развитии, у них недоразвиты половые органы, нет вторичных половых признаков. Если лечение (симптоматическое) начато вовремя и заместительная гормонотерапия адекватная, то можно добиться формирования женского фенотипа, но все пациентки бесплодны (у них нет своих яйцеклеток, так как яичники недоразвиты).
Беременность возможна только путем применения современных репродуктивных технологий – ЭКО с донорской яйцеклеткой на фоне заместительной гормонотерапии.
Существуют варианты неполного синдрома, которые развиваются при генетическом мозаицизме. В таких женщин возможна и спонтанная беременность или лечение путем стимуляции овуляции.
Лечение гиперандрогении у женщин
Лечение гиперандрогении бывает консервативным и хирургическим в зависимости от причины патологии.
Если повышенное образование андрогеновых гормонов вызвано гормонопродуцирующими опухолями или гиперплазией надпочечников, стромальных клеток яичников, то проводят хирургическое удаление данных образований, после чего уровень мужских гормонов снижается самостоятельно и все симптомы проходят.
При консервативном лечении применяют препараты антиандрогенового действия. Самыми известными являются Диане-35, Андрокур. Также применяют терапию оральными контрацептивами, глюкокортикоидами (в зависимости от нозологии).
Лечение должно быть длительным (минимум 8-10 месяцев). Также в лечении косметических дефектов активно применяют косметологические процедуры для удаления избыточных волос, ликвидации последствий акне, себореи.
Если вовремя установлена причина гиперандрогении и приняты все меры для ее ликвидации, то шансы на избавление от всех последствий такого состояния очень высоки. Главное здесь – терпение и выполнение всех врачебных предписаний.
Видео о гиперандрогении у женщин: диагностика и лечение






