Les gens mangent de la citrouille depuis longtemps pour de nombreuses raisons, dont la facilité de culture. Le légume contient des vitamines et des nutriments qui ont un effet bénéfique sur le corps des personnes qui souhaitent obtenir des résultats en matière de perte de poids.
Les bienfaits de la bouillie de citrouille sont inestimables pour les personnes souffrant de maladies cardiaques ou d'anémie. La bouillie additionnée de citrouille est préparée avec et avec du riz.
Les gens ont proposé des options de plats à base de semoule et d'autres céréales, mais ils sont moins populaires en raison de leur teneur en calories. En consommant de la bouillie de citrouille avec du beurre, le corps recevra plus d'avantages, pour cette raison il est préférable de cuisiner avec du lait et de ne pas oublier d'en ajouter. graisse naturelle– les huiles.
- Bénéfice et préjudice ;
- Teneur en calories pour 100 grammes ;
- Avec du lait;
- Sur l'eau;
- Avec du sucre et du beurre ;
- Recettes.
L'avantage de la bouillie de citrouille réside dans le fait qu'elle contient substances nécessaires– phosphore, sodium, magnésium. Le calcium et le potassium, qui font partie du produit, sont nécessaires au corps humain, jeune et âge mûr, ils améliorent l’état des os et des dents.

- K, extrêmement rare et utile ;
Les avantages de la bouillie à la citrouille sont inestimables, car le légume contient de la vitamine K, qui affecte le fonctionnement des intestins et de l'estomac, et en son absence, des saignements de nez et des gencives sont possibles, ce qui peut entraîner Problèmes sérieux dans le futur.
Pectines solubles dans l'eau fibre alimentaire, sont en pulpe, stimulent le travail tractus intestinal, élimine les radionucléides, aide les ulcères à guérir.

Les bienfaits de la bouillie de citrouille ont un effet bénéfique sur le corps, car les composants normalisent l'échange de sel et de liquide. La citrouille ne cause aucun dommage, le produit peut donc être consommé cru ou transformé. Il y avait aussi quelques exceptions aux règles. En ajoutant de la pulpe de citrouille fraîche à votre alimentation, vous ne devez pas oublier les dommages qu'elle cause aux personnes souffrant de problèmes d'estomac.
Types de maladies dans lesquelles la bouillie de citrouille ne cause pas de dommages, mais est bénéfique :
- Gonflement;
- Athérosclérose ;
- Anémie;
- Épuisement.

Teneur en calories
C'est une croyance erronée que la teneur en calories de la bouillie de citrouille est nocive pour la silhouette, car... Il y a 28 kcal pour 100 grammes. La teneur en calories du produit sous sa forme brute est de 22 kcal pour 100 grammes. Vous ne devriez pas vous inquiéter des dommages possibles à votre silhouette, car... les nutritionnistes travaillent depuis longtemps.
Contre-indications :
- Maladies gastro-intestinales ;
- Maladies du pancréas.
Pour éviter de se blesser, mieux vaut consulter un spécialiste. Cela s'applique non seulement à la citrouille, mais également à d'autres types de régimes.
Avec du millet sur l'eau
Le porridge convient aussi bien aux végétariens qu'aux Table de Carême. La teneur en calories pour 100 grammes est de :
- 89 calories ;
- 2,5 grammes. protéines;
- 1,2 grammes. les graisses;
- 16,6 glucides.
Avec du riz et du lait
Un plat préféré des adultes et des enfants. La teneur en calories dépend des ingrédients ajoutés. Si vous ajoutez des raisins secs, des abricots secs ou simplement plus de sucre, la quantité de calories augmentera, ce qui peut affecter votre silhouette, mais sans trop nuire.
Calories pour 100 grammes :
- 89,61 kcal ;
- 2,38 protéines ;
- 0,52 matières grasses ;
- 20,09 glucides.
Lors de l'ajout d'huile, la teneur en calories augmente à 91,5 kcal. Il est important de se rappeler que la bouillie de citrouille avec du mil ou du riz, avec un ajout excessif de sucre cristallisé, augmente la quantité de calories.
Recettes
Version carême de bouillie au mil
- Millet – un verre ;
- Eau – 2,5 verres ;
- Citrouille - un demi-kilo;
- Sel - 7 g;
- Sucre - 35 gr.;
- , si une personne ne jeûne pas et n'est pas végétalienne.
Lavez le mil pour éliminer l'amertume, utilisez uniquement eau chaude. Allumez le four pour qu'il ait le temps de se réchauffer pour une utilisation ultérieure. Épluchez le légume, retirez les graines, coupez-le en petits morceaux et broyez-le au mixeur. Placez le potiron dans un récipient, ajoutez le mil, le sucre, le sel et ajoutez l'eau. Mettre au four pendant une heure à 180 degrés.
Recette classique de bouillie de citrouille avec du riz
Calcul pour 12 portions :
- Citrouille – 1 kg;
- Lait – 5 verres;
- Beurre – 50 gr.;
- Riz - un verre avec une lame ;
- Sucre cristallisé – 1 cuillère à soupe. l.
Épluchez le légume, retirez les graines, râpez-le. Versez le lait dans une casserole, mettez le gaz, ajoutez le potiron, laissez mijoter à feu doux pendant 8 à 9 minutes. Rincez les céréales et ajoutez-les dans la poêle avec le sucre. Faites cuire la bouillie jusqu'à ce qu'elle soit cuite. Si vous le souhaitez, ajoutez beurre une fois la cuisson terminée.
Bouillie de citrouille pour les enfants
Les enfants préfèrent la bouillie avec du lait plutôt que de l'eau, et si vous y ajoutez des épices, le plat deviendra un « rêve pour les gourmands ».
- 800 grammes de pulpe de citrouille ;
- 100 grammes de céréales de blé ;
- 500 ml. lait;
- Raisins secs au goût ;
- Vanille sur la pointe d'un couteau ;
- Une demi-cuillère à café. cannelle;
- Sucre cristallisé au goût.
Rincez les céréales, ajoutez de l'eau, attendez qu'elles bout. Égoutter le liquide, ajouter de l'eau nouvelle sur une hauteur de 4 cm, cuire jusqu'à cuisson. Versez de l'eau bouillante sur la citrouille et faites cuire jusqu'à ce qu'elle devienne tendre. Égouttez le liquide, réduisez-le en purée, mélangez-le avec les céréales. Versez le lait, ajoutez le reste des ingrédients. Cuire le plat pendant 5 minutes, garnir de fruits ou de baies.
Votre retour sur l'article :
Malgré les préjugés du porridge régime journaliéégalement bon pour ceux qui veulent perdre du poids efficacement sans causer de dommages importants à leur propre corps.
Dans ce cas, la bouillie de mil additionnée de citrouille est optimale, considérée comme plus nutritive que la farine d'avoine ou la bouillie à base d'autres céréales.
Bouillie de millet au potiron: composition
Le millet a longtemps été considéré comme un aliment important pour la santé. Il était recommandé d'en manger aux personnes dont la santé était sensiblement affaiblie par la maladie ou épuisée par le travail physique, ainsi qu'aux scientifiques engagés dans une activité mentale et aux enfants pendant les règles. croissance active et le développement.
Il est également recommandé par les nutritionnistes. Pour ceux qui le souhaitent, les experts recommandent de manger chaque jour une portion de bouillie de mil, car les substances qu'elle contient empêchent le dépôt d'excès de graisse, nettoient le corps et le rendent plus élégant.
Tous les bienfaits résident précisément dans la composition chimique de la bouillie de mil : les substances et microéléments qui entrent dans sa composition rendent la bouillie de mil saine et produit nutritif. Le millet contient les micro et macroéléments suivants :
- Magnésium
- Sodium
- Fer
- Manganèse
- Sélénium
- Étain
- Silicium
- Cobalt
- Molybdène
En plus des éléments ci-dessus qui sont bénéfiques pour l'homme, composition chimique mil également inclus diverses vitamines et des acides aminés, dont : les vitamines B, qui améliorent la peau, les cheveux et les ongles, la vitamine K, qui a un effet positif sur la microflore intestinale, la vitamine E, qui renforce le système immunitaire, et le bêta-carotène.
Recette de bouillie à la citrouille
Bouillie de millet à la citrouille: avantages et inconvénients
Comme tout produit, la bouillie de mil à la citrouille a ses propres propriétés bénéfiques et nocives.

Acides aminés (les acides aminocarboxyliques; AMK) - des composés organiques dont la molécule contient simultanément des groupes carboxyle et amine. Les acides aminés peuvent être considérés comme des dérivés d'acides carboxyliques dans lesquels un ou plusieurs atomes d'hydrogène sont remplacés par des groupes aminés.
Histoire
Découverte des acides aminés dans les protéines
Acide aminé Abréviation Année Source Qui a été isolé pour la première fois| Glycine | Gly,G | 1820 | Gélatine | A. Braconno |
| Leucine | Leu, L. | 1820 | Fibre musculaire | A. Braconno |
| Tyrosine | Tyr, Y. | 1848 | Caséine | J. von Liebig |
| Sérine | Ser, S | 1865 | Soie | E. Kramer |
| Acide glutamique | Colle | 1866 | Protéines végétales | G. Ritthausen (allemand) Henri Ritthausen) |
| Glutamine | Gln,Q | |||
| L'acide aspartique | Aspe, D | 1868 | Conglutine, légumineuse (pousses d'asperges) | G.Ritthausen |
| Asparagine | Asn, N. | 1806 | Jus d'asperges | L.-N. Vauquelin et P.J. Robiquet |
| Phénylalanine | Phé, F | 1881 | Pousses de lupin | E. Schulze, J. Barbieri |
| Alanine | Hélas, A | 1888 | Fibroïne de soie | A. Strecker, T. Weil |
| Lysine | Lys, K. | 1889 | Caséine | E. Drexel |
| Arginine | Arg, R. | 1895 | Substance de corne | S. Gedin |
| Histidine | Son, H | 1896 | Sturine, histones | A. Kessel, S. Gedin |
| Cystéine | Cys, C. | 1899 | Substance de corne | K. Moerner |
| Valin | Val, V | 1901 | Caséine | E. Fischer |
| Proline | Pro, P | 1901 | Caséine | E. Fischer |
| Hydroxyproline | Hyp, hP | 1902 | Gélatine | E. Fischer |
| Tryptophane | Trp, W | 1902 | Caséine | F. Hopkins, D. Cole |
| Isoleucine | Ile, je | 1904 | Fibrine | F.Ehrlich |
| Méthionine | Rencontré, M | 1922 | Caséine | D. Möller |
| Thréonine | Thr, T | 1925 | Protéines d'avoine | S. Shriver et coll. |
| Hydroxylysine | Hyl, h.K. | 1925 | Protéines de poisson | S. Shriver et coll. |
Les acides aminés essentiels sont en gras.
Propriétés physiques
Par propriétés physiques Les acides aminés sont très différents de leurs acides et bases correspondants. Tous sont des substances cristallines, se dissolvent mieux dans l'eau que dans les solvants organiques et ont des points de fusion assez élevés ; beaucoup d'entre eux ont bon gout. Ces propriétés indiquent clairement la nature saline de ces composés. Les particularités des propriétés physiques et chimiques des acides aminés sont déterminées par leur structure - la présence à la fois de deux groupes fonctionnels aux propriétés opposées : acide et basique.
Propriétés chimiques générales
Tous les acides aminés sont des composés amphotères ; ils peuvent présenter à la fois propriétés acides, en raison de la présence du groupe carboxyle -COOH dans leurs molécules, et propriétés de base, en raison du groupe amino -NH 2. Les acides aminés interagissent avec les acides et les alcalis :
NH 2 -CH 2 -COOH + HCl → HCl NH 2 -CH 2 -COOH (sel de chlorhydrate de glycine) NH 2 -CH 2 -COOH + NaOH → H 2 O + NH 2 -CH 2 -COONa ( Le sel de sodium glycine)
De ce fait, les solutions d'acides aminés dans l'eau ont les propriétés de solutions tampons, c'est-à-dire qu'elles sont à l'état de sels internes.
NH 2 -CH 2 COOH N+H 3 -CH 2 COO-
Les acides aminés peuvent généralement subir toutes les réactions caractéristiques des acides carboxyliques et des amines.
Estérification :
NH 2 -CH 2 -COOH + CH 3 OH → H 2 O + NH 2 -CH 2 -COOCH 3 (ester méthylique de glycine)
Une caractéristique importante des acides aminés est leur capacité à polycondenser, conduisant à la formation de polyamides, notamment de peptides, de protéines, de nylon et de nylon.
Réaction de formation de peptide :
HOOC -CH 2 -NH -H + HOOC -CH 2 -NH 2 → HOOC -CH 2 -NH -CO -CH 2 -NH 2 + H 2 O
Point isoelectrique les acides aminés sont la valeur du pH à laquelle la proportion maximale de molécules d’acides aminés a une charge nulle. A ce pH, l'acide aminé est le moins mobile dans le champ électrique, et cette propriété peut être utilisé pour séparer les acides aminés ainsi que les protéines et les peptides.
Un zwitterion est une molécule d'acide aminé dans laquelle le groupe amino est représenté par -NH 3 + et le groupe carboxy est représenté par -COO−. Une telle molécule a un moment dipolaire significatif avec une charge nette nulle. C’est à partir de ces molécules que sont construits les cristaux de la plupart des acides aminés.
Certains acides aminés ont plusieurs groupes aminés et groupes carboxyle. Pour ces acides aminés, il est difficile de parler d’un zwitterion spécifique.
Reçu
La plupart des acides aminés peuvent être obtenus par hydrolyse de protéines ou à la suite de réactions chimiques :
CH 3 COOH + Cl 2 + (catalyseur) → CH 2 ClCOOH + HCl; CH2ClCOOH+ 2 NH3 → NH 2 -CH 2 COOH + NH 4 Cl
Isomérie optique
Tous les acides α-aminés présents dans les organismes vivants, à l'exception de la glycine, contiennent un atome de carbone asymétrique (la thréonine et l'isoleucine contiennent deux atomes asymétriques) et ont une activité optique. Presque tous les acides aminés α naturels ont la configuration L, et seuls les acides aminés L sont inclus dans les protéines synthétisées sur les ribosomes.
Acides D-aminés dans les organismes vivants
Les résidus aspartiques dans les protéines structurelles métaboliquement inactives subissent une lente racémisation spontanée non enzymatique : dans les protéines de la dentine et de l'émail dentaire, le L-aspartate se convertit en forme D à un taux d'environ 0,1 % par an, qui peut être utilisé pour déterminer l'âge des mammifères. . Une racémisation de l'aspartate a également été notée au cours du vieillissement du collagène ; on suppose qu'une telle racémisation est spécifique de l'acide aspartique et se produit en raison de la formation d'un cycle succinimide lors de l'acylation intramoléculaire de l'atome d'azote de la liaison peptidique par le groupe carboxyle libre de l'acide aspartique.
Avec le développement de l'analyse des acides aminés traces, les acides aminés D ont été découverts d'abord dans les parois cellulaires de certaines bactéries (1966), puis dans les tissus. organismes supérieurs. Ainsi, le D-aspartate et la D-méthionine sont vraisemblablement des neurotransmetteurs chez les mammifères.
Certains peptides contiennent des acides aminés D formés lors d’une modification post-traductionnelle. Par exemple, la D-méthionine et la D-alanine font partie des heptapeptides opioïdes présents dans la peau des amphibiens phyllomedusa d'Amérique du Sud (dermorphine, dermenképhaline et deltorphines). La présence d'acides D-aminés détermine la haute activité biologique de ces peptides en tant qu'analgésiques.
Les antibiotiques peptidiques se forment de la même manière origine bactérienne, agissant contre les bactéries à Gram positif - nisine, subtiline et épidermine.
Beaucoup plus souvent, les acides D-aminés font partie des peptides et de leurs dérivés, formés par synthèse non ribosomale dans les cellules de champignons et de bactéries. Apparemment, dans ce cas, le matériau de départ de la synthèse est également constitué d'acides L-aminés, qui sont isomérisés par l'une des sous-unités du complexe enzymatique qui réalise la synthèse du peptide.
Acides aminés protéinogènes
Article principal : ÉcureuilsAu cours du processus de biosynthèse des protéines, 20 acides aminés α, codés par le code génétique, sont inclus dans la chaîne polypeptidique. En plus de ces acides aminés, appelés protéinogène, ou standard, certaines protéines contiennent des acides aminés spécifiques non standard qui proviennent d'acides aminés standards au cours du processus de modifications post-traductionnelles. DANS Dernièrement La sélénocystéine (Sec, U) et la pyrrolysine (Pyl, O) incluses dans la traduction sont parfois considérées comme des acides aminés protéinogènes. Ce sont ce qu’on appelle les 21e et 22e acides aminés.
La question de savoir pourquoi exactement ces 20 acides aminés ont été « choisis » reste en suspens. On ne sait pas exactement pourquoi ces acides aminés se sont avérés préférables à d’autres similaires. Par exemple, un métabolite intermédiaire clé dans la voie de biosynthèse de la thréonine, de l'isoleucine et de la méthionine est l'homosérine, un acide aminé α. Évidemment, l’homosérine est un métabolite très ancien, mais il existe des aminoacyl-ARNt synthétases, des ARNt, pour la thréonine, l’isoleucine et la méthionine, mais pas pour l’homosérine.
Les formules développées des 20 acides aminés protéinogènes sont généralement données sous la forme de ce qu'on appelle tableaux des acides aminés protéinogènes:

Pour mémoriser la désignation à une lettre des acides aminés protéinogènes, utilisez règle mnémotechnique(dernière colonne).
| Glycine | Gly | g | g lycine |
| Alanine | Hélas | UN | UN lanine |
| Valin | Val | V | V une ligne |
| Isoleucine | Île | je | je soleucine |
| Leucine | Leu | L | L eucine |
| Proline | Pro | P. | P. roline |
| Sérine | Ser | S | SÉrine |
| Thréonine | Thr | T | T hréonine |
| Cystéine | Cys | C | C ysteine |
| Méthionine | Rencontré | M | Méthionine |
| L'acide aspartique | Aspic | D | aspar D acide ique |
| Asparagine | Asn | N | asperges N e |
| Acide glutamique | Glu | E | glu E acide tamique |
| Glutamine | Gln | Q | Q-tamine |
| Lysine | Lys | K | avant L |
| Arginine | Arg | R. | un R. ginine |
| Histidine | Son | H | H istidine |
| Phénylalanine | Phé | F | Fénylalanine |
| Tyrosine | Tyr | Oui | t Oui colophane |
| Tryptophane | Trp | W | t W o anneaux |
Classification
Par radical
- Non polaire : glycine, alanine, valine, isoleucine, leucine, proline
- Polaire non chargé (charges compensées) à pH=7 : sérine, thréonine, cystéine, méthionine, asparagine, glutamine
- Aromatique : phénylalanine, tryptophane, tyrosine
- Polaire chargé négativement à pH=7 : aspartate, glutamate
- Polaire chargée positivement à pH=7 : lysine, arginine, histidine
Par groupes fonctionnels
- Aliphatique
- Acides monoaminomonocarboxyliques : glycine, alanine, valine, isoleucine, leucine
- Acides oxymonoaminocarboxyliques : sérine, thréonine
- Acides monoaminodicarboxyliques : aspartate, glutamate, en raison du deuxième groupe carboxyle, ils portent une charge négative en solution
- Amides monoaminodicarboniques : asparagine, glutamine
- Acides diaminomonocarboxyliques : lysine, arginine, portent une charge positive en solution
- Contenant du soufre : cystéine, méthionine
- Aromatique : phénylalanine, tyrosine, tryptophane,
- Hétérocyclique : tryptophane, histidine, proline
- Acides aminés : proline
Par classe d'aminoacyl-ARNt synthétases
- Classe I : valine, isoleucine, leucine, cystéine, méthionine, glutamate, glutamine, arginine, tyrosine, tryptophane
- Classe II : glycine, alanine, proline, sérine, thréonine, aspartate, asparagine, histidine, phénylalanine
Pour l’acide aminé lysine, il existe des aminoacyl-ARNt synthétases des deux classes.
Par voies de biosynthèse
Les voies de biosynthèse des acides aminés protéinogènes sont diverses. Le même acide aminé peut être formé de différentes manières. De plus, complètement différentes façons peut avoir des étapes très similaires. Néanmoins, il existe des tentatives justifiées pour classer les acides aminés selon les voies de leur biosynthèse. On connaît les familles biosynthétiques d'acides aminés suivantes : aspartate, glutamate, sérine, pyruvate et pentoses. Il n’est pas toujours possible d’attribuer sans ambiguïté un acide aminé spécifique à une famille spécifique ; des ajustements sont effectués pour des organismes spécifiques et en tenant compte de la voie prédominante. Les acides aminés sont généralement classés dans les familles suivantes :
- Famille des aspartates : aspartate, asparagine, thréonine, isoleucine, méthionine, lysine.
- Famille glutamate : glutamate, glutamine, arginine, proline.
- Famille des pyruvates : alanine, valine, leucine.
- Famille des sérines : sérine, cystéine, glycine.
- Famille des pentoses : histidine, phénylalanine, tyrosine, tryptophane.
La phénylalanine, la tyrosine et le tryptophane sont parfois classés dans la famille des shikimates.
Selon la capacité du corps à synthétiser à partir de précurseurs
- Essentiel Pour la plupart des animaux et des humains, les acides aminés essentiels sont : la valine, l'isoleucine, la leucine, la thréonine, la méthionine, la lysine, la phénylalanine, le tryptophane.
- Non essentiels Pour la plupart des animaux et des humains, les acides aminés non essentiels sont : la glycine, l'alanine, la proline, la sérine, la cystéine, l'aspartate, l'asparagine, le glutamate, la glutamine, la tyrosine.
La classification des acides aminés en remplaçables et essentiels n'est pas sans inconvénients. Par exemple, la tyrosine n’est un acide aminé non essentiel que s’il existe un apport suffisant en phénylalanine. Pour les patients atteints de phénylcétonurie, la tyrosine devient un acide aminé essentiel. L'arginine est synthétisée dans le corps humain et est considérée comme un acide aminé non essentiel, mais en raison de certaines caractéristiques de son métabolisme dans certaines conditions physiologiques du corps, elle peut être assimilée à un acide aminé essentiel. L'histidine est également synthétisée dans le corps humain, mais pas toujours en quantité suffisante, elle doit donc être apportée par la nourriture.
Selon la nature du catabolisme chez les animaux
La biodégradation des acides aminés peut se produire de différentes manières.
Selon la nature des produits cataboliques chez les animaux, les acides aminés protéinogènes sont divisés en trois groupes :
- Glucogénique - lors de leur dégradation, ils produisent des métabolites qui n'augmentent pas le niveau corps cétoniques, capable de devenir relativement facilement un substrat de la gluconéogenèse : pyruvate, α-cétoglutarate, succinyl-CoA, fumarate, oxaloacétate
- Cétogène - se décompose en acétyl-CoA et acétoacétyl-CoA, qui augmentent le niveau de corps cétoniques dans le sang des animaux et des humains et sont principalement convertis en lipides
- Gluco-cétogène - lors de la dégradation, des métabolites des deux types se forment
Acides aminés:
- Glucogénique : glycine, alanine, valine, proline, sérine, thréonine, cystéine, méthionine, aspartate, asparagine, glutamate, glutamine, arginine, histidine.
- Cétogène : leucine, lysine.
- Gluco-cétogène (mixte) : isoleucine, phénylalanine, tyrosine, tryptophane.
Les acides aminés de Miller
Article principal : Expérience Miller-UreyLes acides aminés « Miller » sont un nom généralisé pour les acides aminés obtenus dans des conditions similaires à l'expérience de Stanley L. Miller de 1953. La formation sous forme de racémate de nombreux acides aminés différents a été établie, notamment : glycine, alanine, valine, isoleucine, leucine, proline, sérine, thréonine, aspartate, glutamate.
Composés apparentés
En médecine, un certain nombre de substances capables d'accomplir certains fonctions biologiques acides aminés, également (bien que pas tout à fait correctement) appelés acides aminés :
- Taurine
Application
Une caractéristique importante des acides aminés est leur capacité à polycondenser, conduisant à la formation de polyamides, notamment de peptides, de protéines, de nylon, de nylon et d'énant.
Les acides aminés sont inclus dans nutrition sportive et des aliments mélangés. Les acides aminés sont utilisés dans l'industrie alimentaire comme additifs aromatisants, par exemple le sel de sodium de l'acide glutamique.
3.3 Signification biologique des acides aminés
1. Ils font partie des peptides et des protéines des objets biologiques.
2. Ils sont les précurseurs de nombreux produits biologiques de faible poids moléculaire. substances actives– l'acide gamma-aminobutyrique (GABA, amines biogènes).
Certaines hormones sont des dérivés d'acides aminés.
3. Ce sont des précurseurs de bases azotées qui font partie des acides nucléiques et des lipides complexes (choline, éthanoamine).
4.Participer à la biosynthèse des médiateurs du système nerveux (acétylcholine, dopamine, sérotonine, etc.).
4 réactions colorées aux protéines
La présence de protéines dans des objets ou des solutions biologiques peut être détectée à l'aide de réactions colorées, qui sont déterminées par la présence d'acides aminés dans la protéine, de leurs groupes spécifiques ou de leurs groupes peptidiques.
Il existe des réactions colorées universelles que donnent toutes les protéines (biuret et ninhydrine). De plus, certaines réactions spécifiques sont provoquées par la présence de certains acides aminés dans la molécule protéique. Des méthodes ont été développées sur la base de certaines réactions colorées quantification protéines et acides aminés, largement utilisés dans les analyses biochimiques.
Dans ce travail, l'étudiant doit non seulement réaliser des réactions universelles et spécifiques aux protéines, mais aussi tirer une conclusion sur la valeur nutritionnelle protéines étudiées, qui est déterminée par le contenu acides aminés essentiels.
Il existe huit acides aminés essentiels (essentiels) pour l'homme : valine (Val), leucine (Leu), isoleucine (Ile), thréonine (Tre), méthionine (Met), lysine (Lys), phénylalanine (Phen), tryptophane (Trp ). Deux acides aminés sont partiellement essentiels : l'arginine et l'histidine. Ils ne sont pas synthétisés dans le corps des enfants. Ces acides aminés, comme tous les autres, sont synthétisés par des micro-organismes et des plantes vertes, mais ne peuvent pas être synthétisés dans le corps des animaux et des humains, car il n'existe pas d'analogues des acides cétoniques correspondants nécessaires à leur biosynthèse. Les acides aminés essentiels doivent être introduits dans le corps humain ou animal avec de la nourriture. S'il n'y en a pas assez dans la nourriture, alors développement normal et les fonctions vitales du corps sont perturbées, car les protéines qui les contiennent ne peuvent pas être synthétisées.
Séparé protéines alimentaires peuvent être biologiquement déficients dans leur composition en acides aminés. Cependant, il est nécessaire d'étudier la composition en acides aminés non pas des protéines individuelles, mais de l'ensemble de leur complexe contenu dans un produit alimentaire. Ce n'est qu'avec cette approche que l'on peut obtenir des données correctes sur la composition en acides aminés, et donc sur la valeur nutritionnelle du produit. Pour la nutrition, l'équilibre de la composition en acides aminés des protéines est d'une grande importance.
Sur la base de la teneur en acides aminés essentiels de la protéine, déterminée par des méthodes chimiques, le score d'acides aminés est calculé, qui caractérise valeur biologiqueécureuil. La teneur en chaque acide aminé essentiel du produit est déterminée. La quantité trouvée est calculée en pourcentage de la teneur du même acide aminé dans protéine idéale (œuf de poule, lait). Le plus souvent, l'échelle des acides aminés du Comité FAO/OMS est utilisée comme protéine idéale (FAO Organisation des Nations Unies pour l'alimentation et l'agriculture - une organisation intergouvernementale, une agence spécialisée des Nations Unies. OMS - Organisation mondiale soins de santé).
Le score d'acides aminés de chaque acide aminé essentiel dans une protéine idéale (échelle FAO/OMS) est pris à 100 %.
Le score d’acides aminés est calculé à l’aide de la formule :
АK = 100, (2)
où AK est un acide aminé ;
Sur la base du score calculé, la valeur biologique limite de la protéine étudiée est déterminée. L'acide aminé ayant le taux le plus faible est déficient en une protéine donnée. Pour protéine végétale La lysine, le tryptophane, la méthionine et la thréonine sont le plus souvent déficientes. Les protéines animales de la viande, du lait et des œufs sont biologiquement plus précieuses, car... leur composition en acides aminés est plus proche de celle des organes et des tissus.
Des questions. L'utilisation d'acides aminés et de leurs dérivés comme
Médicaments
L'utilisation d'acides aminés et de leurs dérivés comme
Importance médicale et biologique des acides aminés
Extrémité N Extrémité C
Acide aminé acide aminé
Nomenclature des peptides
Les polypeptides sont nommés comme dérivés de l'acide aminé C-terminal, le nom commence par l'acide aminé N-terminal, énumérant tout dans l'ordre (en changeant la terminaison en limon), se termine par un acide aminé C-terminal. Peut être enregistré noms complets, abrégé (en transcription latine ou en russe)
Exemple : glycylalanylglutamylvaline (gly-ala – gly-val ou gly-ala-glu-val)
En plus de participer à la biosynthèse des protéines, les acides aminés remplissent de nombreuses autres fonctions indépendantes.
1. participer à la biosynthèse des neurotransmetteurs et des hormones :
L’acétylcholine, médiateur du système nerveux parasympathique, est formée à partir de l’acide aminé sérine.
Le médiateur du système nerveux sympathique, la noradrénaline, ainsi que les hormones adrénaline et thyroxine, sont formés à partir de la phénylalanine ou de la tyrosine.
Le GABA est synthétisé à partir de l'acide glutamique
2. Les acides aminés glycine et glutamique ont des fonctions de neurotransmetteur
3. L'acide aspartique est nécessaire à la synthèse des bases azotées des acides nucléiques (adénine, guanine, uracile, thymine, cytosine)
4. les acides glutamique et aspartique participent à la neutralisation de l'ammoniac
5. L'acide aminé méthionine transfère son groupe méthyle actif pour former de la thymine, de la choline et de l'adrénaline.
6. Dans des conditions de carence en glucides, le glucose est synthétisé à partir des acides aminés du corps humain.
Par conséquent, les acides aminés sont utilisés comme médicaments :
acide glutamique, méthionine, glycine, cystéine, tryptophane.
Aminalon (Aminalon)– L’acide 4-aminobutanoïque (GABA) est une poudre cristalline blanche au goût amer. Facilement soluble dans l'eau, très peu dans l'alcool. Mercredi 5% solution aqueuse proche du neutre (pH = 6,5 -7,5)
L'application est associée à un niveau élevé activité biologique en tant que neurotransmetteur inhibiteur et participation aux processus métaboliques dans le cerveau.
Utilisé pour maladies vasculaires cerveau, maux de tête accompagnés de troubles de la mémoire et de la parole, après un traumatisme crânien et un accident vasculaire cérébral., avec maladie alcoolique. Chez les enfants présentant des troubles du développement neuropsychique, avec paralysie cérébrale. Forme de libération : comprimés.
1. Pourquoi ce composé est-il peu soluble dans l'alcool, alors que le 1-aminobutane et l'acide butanoïque, qui contiennent le même nombre d'atomes de carbone que l'aminalone, sont très solubles dans l'alcool ?
Cystéine (Cysteinum)– Acide 2-amino-3-mercaptopropanoïque
Blanc poudre cristalline, facilement soluble dans l'eau. La cystéine est impliquée dans de nombreux processus métaboliques de l'organisme, les groupes HS participent à la stabilisation de la structure tertiaire de la protéine, à la formation d'un groupe sulfo - OSO 3 H, présent dans les polysaccharides (par exemple, l'anticoagulant sanguin héparine ). La cystéine est nécessaire au métabolisme du cristallin ; un manque de cystéine contribue au développement de la cataracte.
La cystéine s'utilise sous forme de solution aqueuse à 2% pour l'électrophorèse, les bains oculaires, la préparation gouttes pour les yeux. La poudre est produite dans des flacons en verre foncé, bien fermés, les bouchons sont remplis de paraffine. Les solutions sont préparées immédiatement avant utilisation. Conserver dans un endroit sombre, à l'abri de la lumière.
80. Désamination oxydative des acides aminés ; glutamate déshydrogénase. Désamination indirecte des acides aminés. Signification biologique.
Désamination des acides aminés - la réaction d'élimination d'un groupe α-amino d'un acide aminé, entraînant la formation de l'acide α-céto correspondant (un résidu sans azote) et la libération d'une molécule d'ammoniac. L'ammoniac est toxique pour le système nerveux central, c'est pourquoi dans le corps des humains et des mammifères, il est converti en un composé non toxique et hautement soluble - l'urée. L'ammoniac est excrété par l'organisme sous forme d'urée, ainsi que sous forme de sels d'ammonium. Le résidu sans azote est utilisé pour former des acides aminés dans les réactions de transamination, dans les processus de gluconéogenèse, de cétogenèse, dans les réactions anaplérotiques pour reconstituer la perte de métabolites OPA, dans les réactions d'oxydation en CO 2 et H 2 O.
Il existe plusieurs façons de désaminer les acides aminés :

Désamination oxydative. La désamination la plus active de l'acide glutamique se produit dans les tissus. La réaction est catalysée par une enzyme glutamate déshydrogénase, Le coenzyme de la glutamate déshydrogénase est le NAD+. La réaction se déroule en 2 étapes. Il se produit d'abord une déshydrogénation enzymatique du glutamate et la formation d'a-iminoglutarate, puis une élimination hydrolytique non enzymatique du groupe imino sous forme d'ammoniac, entraînant la formation d'a-cétoglutarate. . Désamination oxydative du glutamate - la réaction est réversible et lorsque la concentration d'ammoniac dans la cellule augmente, elle peut se dérouler dans la direction opposée, comme attelle de restauration α -cétoglutarate . La glutamate déshydrogénase est très active dans les mitochondries des cellules de presque tous les organes, à l'exception des muscles. Cette enzyme est un oligomère constitué de 6 sous-unités ( masse moléculaire 312 kD). La glutamate déshydrogénase joue rôle important, puisqu'il s'agit d'une enzyme régulatrice métabolisme des acides aminés. Les inhibiteurs allostériques de la glutamate déshydrogénase (ATP, GTP, NADH) provoquent la dissociation de l'enzyme et la perte de l'activité de la glutamate déshydrogénase. Concentrations élevées L'ADP active l'enzyme. Si bas niveau d'énergie dans les cellules, il stimule la destruction des acides aminés et la formation d'α-cétoglutarate, qui entre dans le cycle du TCA comme substrat énergétique. La glutamate déshydrogénase peut être induite hormones stéroïdes(cortisol).
L-acide aminé oxydase . Enzyme présente dans le foie et les reins L-acide aminé oxydase , capable de désaminer certains acides aminés L. Le coenzyme dans cette réaction est le FMN. Cependant, la contribution de la L-aminoacide oxydase à la désamination est évidemment insignifiante, puisque l'optimum de son action se situe en milieu alcalin (pH 10,0). Dans les cellules où le pH de l’environnement est proche de la neutralité, l’activité enzymatique est très faible.
D-aminoacide oxydase également trouvé dans les reins et le foie. C'est une enzyme dépendante du FAD. Le pH optimal de cette oxydase se situe dans un environnement neutre, l’enzyme est donc plus active que la L-aminoacide oxydase. Le rôle de la D-aminoacide oxydase est faible, car le nombre d'isomères D dans le corps est extrêmement faible, car les protéines alimentaires et les protéines des tissus humains et animaux ne contiennent que des acides aminés L naturels. Il est probable que la D-aminoacide oxydase favorise leur conversion en isomères L correspondants.
Désamination indirecte (transdéamination) La plupart des acides aminés ne peuvent pas être désaminés en une seule étape, comme Glu. Les groupes aminés de ces acides aminés, à la suite de la transamination, sont transférés à l'α-cétoglutarate pour former de l'acide glutamique, qui subit ensuite une désamination oxydative directe. Ce mécanisme de désamination des acides aminés au stade 2 est appelé transdéamination, ou désamination indirecte :

La désamination indirecte des acides aminés se produit avec la participation de 2 enzymes : l'aminotransférase (coenzyme PF) et la glutamate déshydrogénase (coenzyme NAD+).
L'importance de ces réactions dans le métabolisme des acides aminés est très grande, puisque la désamination indirecte est la principale méthode de désamination de la plupart des acides aminés . Les deux étapes de désamination indirecte sont réversibles, ce qui permet à la fois le catabolisme des acides aminés et la possibilité de former presque n'importe quel acide aminé à partir de l'acide α-céto correspondant.
DANS tissu musculaire L'activité de la glutamate déshydrogénase est donc faible dans ces cellules à intense activité physique Il existe une autre voie de désamination indirecte impliquant le cycle IMP-AMP. Tout d’abord, le groupe amino des acides aminés est transféré à l’aspartate, puis à l’acide inosinique (IPA) et enfin, l’AMP est désaminé. Le schéma présenté reflète la séquence de réactions indirectes de désamination non oxydante :

Il y a 4 étapes du processus :
transamination par l'α-cétoglutarate, formation de glutamate ;
transamination du glutamate avec l'oxaloacétate (enzyme ACT), formation d'aspartate ;
la réaction de transfert d'un groupe amino de l'aspartate à l'IMP (inosine monophosphate), la formation d'AMP et de fumarate ;
désamination hydrolytique de l'AMP.
Le transfert du groupe amino de l'aspartate et la synthèse de l'AMP se déroulent comme suit.
La réaction de désamination de l'acide adénylique se produit sous l'action de l'enzyme AMP désaminase. Cette voie de désamination prédomine dans les muscles lors d'un travail intense, à la suite de laquelle l'acide lactique s'accumule. L'ammoniac libéré empêche l'acidification de l'environnement des cellules provoquée par la formation de lactate.
Rôle biologique de la désamination indirecte. A - avec le catabolisme, presque tout acides aminés naturels transférez d’abord le groupe amino à l’α-cétoglutarate dans une réaction de transamination pour former du glutamate et l’acide céto correspondant. Le glutamate subit ensuite une désamination oxydative directe sous l'action de la glutamate déshydrogénase, entraînant l'α-cétoglutarate et l'ammoniac ; B - s'il est nécessaire de synthétiser des acides aminés et la présence des acides α-céto nécessaires, les deux étapes de désamination indirecte se déroulent dans le sens opposé. À la suite de l'amination réductrice de l'α-cétoglutarate, il se forme du glutamate, qui entre en transamination avec l'acide α-céto correspondant, ce qui conduit à la synthèse d'un nouvel acide aminé.

Les acides aminés et leur rôle dans l'organisme
Les acides aminés sont des acides carboxyliques organiques dans lesquels au moins un des atomes d'hydrogène de la chaîne hydrocarbonée est remplacé par un groupe amino.
Il existe environ 300 acides aminés présents dans la nature. Beaucoup d’entre eux ne se trouvent que dans certains organismes, et certains ne se trouvent que dans un organisme particulier. Le corps humain contient environ 60 acides aminés différents et leurs dérivés.
Les acides aminés sont divisés en deux groupes : protéinogènes (inclus dans les protéines - il y en a 20) et non protéinogènes (non impliqués dans la formation des protéines).
Trois classifications d'acides aminés sont acceptées :
Structurel – basé sur la structure du radical latéral ;
Électrochimique – selon les propriétés acido-basiques ;
Biologique - selon le degré d'acides aminés essentiels pour l'organisme.
Les acides aminés essentiels ne peuvent pas être synthétisés par l’organisme à partir d’autres composés, ils doivent donc provenir de l’alimentation. Il existe huit acides aminés absolument essentiels pour l'homme : valine, leucine, isoleucine, thréonine, lysine, méthionine, phénylalanine, tryptophane.
Les acides aminés partiellement remplaçables sont l'arginine et l'histidine.
Acides aminés modifiés présents dans les protéines
La modification des résidus d'acides aminés s'effectue déjà dans la composition des protéines, c'est-à-dire seulement après la fin de leur synthèse.
La molécule de collagène contient :
4- hydroxyproline
5-hydroxylysine
L'introduction de groupes fonctionnels supplémentaires dans la structure des acides aminés confère aux protéines les propriétés nécessaires à leur fonctionnement. fonctions spécifiques. Donc γ-carboxyglutamine Il fait partie des protéines impliquées dans la coagulation sanguine. Deux groupes carboxyle étroitement liés sont nécessaires à la liaison des protéines aux ions Ca2+. Une carboxylation altérée du glutamate entraîne une diminution de la coagulation sanguine.
Les acides aminés comme médicaments
Acides aminés trouvés utilisation indépendante comme médicaments. Vous trouverez ci-dessous leurs brèves caractéristiques pharmacologiques.
Acide glutamique stimule les processus d'oxydation dans le corps, favorise la neutralisation et l'élimination de l'ammoniac du corps, active la synthèse de l'acétylcholine et de l'ATP et est un médiateur qui stimule la transmission de l'excitation dans les synapses du système nerveux central. Il est utilisé principalement dans le traitement des maladies du système nerveux central : épilepsie, états réactifs se manifestant par des symptômes d'épuisement et de dépression, paralysie cérébrale, Maladie de Down, etc.
Méthionine – un acide aminé essentiel nécessaire au maintien de la croissance et de l’équilibre azoté de l’organisme, a un effet lipotrope et augmente la fonction antitoxique du foie. La méthionine est utilisée pour traiter et prévenir les maladies et lésions toxiques foie, ainsi que alcoolisme chronique, diabète sucré, athérosclérose, etc.
Ornithine réduit la concentration d'ammoniac dans le plasma sanguin, favorise la normalisation l'equilibre acide-base dans l'organisme. Prescrit pour le traitement de l'hépatite, de la cirrhose du foie, encéphalopathie hépatique, coma hépatique, lésions hépatiques d'origine alcoolique.
Histidine – un acide aminé essentiel qui subit une décarboxylation dans l’organisme pour former de l’histamine. Le chlorhydrate d'histidine a été proposé pour le traitement ulcère gastroduodénal l'estomac et le duodénum, ainsi que l'athérosclérose.
Glycine – un neurotransmetteur central de type inhibiteur, a un effet calmant, améliore processus métaboliques dans le tissu cérébral. Recommandé comme remède qui affaiblit le besoin d'alcool, réduisant ainsi le phénomène de sevrage chez les patients souffrant d'alcoolisme chronique.
Cystéine participe au métabolisme du cristallin et est proposé pour retarder le développement de la cataracte et nettoyer le cristallin dans les formes initiales de cataracte.
Taurine contribue à l'amélioration processus énergétiques dans l'organisme, dans le système nerveux central, il joue le rôle de neurotransmetteur inhibiteur et a une activité anticonvulsive. Un des traits caractéristiques la taurine est sa capacité à stimuler les processus réparateurs dans les troubles dystrophiques de la rétine et les lésions traumatiques des tissus oculaires.
Citrulline – un acide aminé impliqué dans la biosynthèse de l’urée dans le cycle de l’ornithine. Aide à normaliser le métabolisme et à activer les facteurs de protection non spécifiques du corps. Il est demandé pour thérapie symptomatique asthénine fonctionnelle (contre le surmenage, la fatigue, en période postopératoire, chez les sportifs, etc.).
Transamination des acides aminés
La transamination est la réaction de transfert d'un groupe -aminé d'un acide aminé à un acide -céto, entraînant la formation d'un nouvel acide céto et d'un nouvel acide aminé. Les réactions sont catalysées par les enzymes aminotransférases. Il s'agit d'enzymes complexes dont le coenzyme est un dérivé de la vitamine B 6 - le phosphate de pyridoxal, qui peut être converti de manière réversible en phosphate de pyridoxamine. Les réactions de transamination sont réversibles et peuvent avoir lieu aussi bien dans le cytoplasme que dans les mitochondries des cellules. Plus de 10 aminotransférases, différant par leur spécificité de substrat, ont été trouvées dans les cellules humaines. Presque tous les acides aminés peuvent subir des réactions de transamination, à l'exception de la lysine, de la thréonine et de la proline.
Les réactions de transamination se déroulent en 2 étapes. Lors de la première étape, un groupe amino du premier substrat, un acide aminé, est ajouté au phosphate de pyridoxal dans le centre actif de l'enzyme. Un complexe d'enzyme-pyridoxamine phosphate et d'acide céto se forme - le premier produit de la réaction. Ce processus implique la formation intermédiaire de 2 bases de Schiff (aldimine et kétimine).
Dans la deuxième étape, le phosphate de pyridoxamine se combine avec un nouvel acide céto (deuxième substrat) et à nouveau, par la formation intermédiaire de 2 bases de Schiff, transfère un groupe amino à l'acide céto. En conséquence, l'enzyme revient à sa forme native et un nouvel acide aminé est formé - le deuxième produit de la réaction.

Le plus souvent, les réactions de transamination impliquent des acides aminés dont la teneur dans les tissus est nettement supérieure à celle des autres - glutamate, alanine, aspartate. Les plus abondantes dans la plupart des tissus sont l’alanine aminotransférase (ALT) et l’aspartate aminotransférase (AST).
La plus grande activité de l'AST se trouve dans les cellules du muscle cardiaque et du foie, tandis que seule l'activité de fond de l'ALT et de l'AST se trouve dans le sang. On peut donc parler de la spécificité organique de ces enzymes, ce qui leur permet d'être largement utilisées avec objectif diagnostique(pour l'infarctus du myocarde et l'hépatite).
Signification biologique de la transamination
La transamination est la première étape de la désamination de la plupart des acides aminés, c'est-à-dire Première étape leur catabolisme. Les acides cétoniques résultants sont oxydés dans le cycle TCA ou utilisés pour la synthèse de corps glucose et cétoniques. Puisque ce processus est réversible, les enzymes aminotransférases fonctionnent à la fois dans le catabolisme et dans la biosynthèse des acides aminés. Transamination – La dernière étape synthèse d'acides aminés non essentiels à partir des acides cétoniques correspondants, s'ils sont actuellement nécessaires aux cellules. En conséquence, l’azote aminé est redistribué dans les tissus. Pendant la transamination total les acides aminés dans la cellule ne changent pas.
D-aminoacides oxydases. À valeurs physiologiques Les D-aminoacides oxydases sont très actives dans le pH des tissus. On les trouve également dans les reins et le foie, ainsi que dans les microsomes. Le rôle des D-aminoacides oxydases est faible et n’est pas entièrement compris, car les protéines présentes dans les aliments et les tissus humains ne contiennent que des acides L-aminés naturels.
Le foie humain contient des enzymes spécifiques qui catalysent les réactions de désamination de la sérine, de la thréonine, de la cystéine et de l'histidine de manière non oxydative.
Signification biologique des acides phminiques
Homo sapiens
Croyez-le : les acides aminés ne font pas partie des acides nucléiques. Est-ce comme ça bases azotées, et encore pas directement.
La signification des acides aminés est :
1) Tamponnage de la composition cellulaire, c'est-à-dire maintenir le niveau de pH à un niveau constant.
2) La base structurelle de la cellule (une partie des protéines qui composent les hormones, la membrane cellulaire avec des protéines intercalées en mosaïque, etc.) :
Lors de la traduction, un acide aminé est activé par sa fixation à l'ARN et l'apparition d'un complexe acide aminé-ARNt dû à l'énergie de l'ATP (et de l'enzyme aminoacyl-ARN synthétase). Le complexe est ensuite transféré dans la sous-unité 30S. Le complexe d'initiation méthionine-ARNt correspond au triplet AUG dans le ribosome. L'initiation commence, au cours de laquelle la liaison de l'ARNm et de l'ARNt à la petite sous-unité du ribosome se produit grâce à la conformation de la protéine IF2 (centre de reconnaissance des acides aminés de l'acide aminé dans la sous-unité). Après que IF3 et IF1 sortent de la grande sous-unité, le complexe ARNm-ARNt-méthionine-sous-unité 30S se lie à la sous-unité 50S, provoquant sa conformation et l'apparition d'un ribosome. Codé pour la méthionine. L'allongement commence. L'anticodon d'ARN et le codon d'ARNm sont lus, ce qui fait avancer l'acide aminé d'un triplet. À la fin, l'acide aminé est ajouté à la méthionine au centre P du ribosome, l'acide aminé suivant est ajouté à l'acide aminé actuel, etc.
3) Énergie.
Les acides aminés sont les éléments constitutifs de toutes les protéines du corps. En musculation, les acides aminés revêtent une importance particulière, car les muscles sont presque entièrement composés de protéines, c'est-à-dire d'acides aminés. Le corps les utilise pour propre croissance, restauration, renforcement et production de diverses hormones, anticorps et enzymes. Non seulement la croissance de la force musculaire et de la « masse » en dépend, mais aussi la restauration du tonus physique et mental après l'entraînement, le catabolisme graisse sous cutanée et même l’activité intellectuelle du cerveau est une source de stimuli motivationnels. Il existe au total 20 acides aminés protéinogènes, dont neuf sont dits « essentiels » ou irremplaçables (l'organisme ne peut pas les synthétiser indépendamment en quantité suffisante), les autres sont dits non essentiels. Il existe également un certain nombre d'acides aminés qui ne font pas partie de la structure protéique, mais qui jouent un rôle important dans le métabolisme (carnitine, ornithine, taurine, GABA).
Liste d'acides aminés avec de brèves caractéristiques
Acides aminés essentiels- Ce sont des acides aminés que l'organisme n'est pas capable de synthétiser lui-même et ne peut les obtenir qu'à partir d'aliments et de suppléments.
Acides aminés conditionnellement essentiels- synthétisé dans l'organisme en quantité insuffisante.
Acides aminés non essentiels- l'organisme peut le synthétiser lui-même, mais un apport supplémentaire a ses propres bénéfices.
Acides aminés essentiels:
Valin. L'un des principaux composants de la croissance et de la synthèse des tissus corporels. La principale source est constituée de produits d’origine animale. Des expériences sur des rats de laboratoire ont montré que la valine augmente la coordination musculaire et réduit la sensibilité du corps à la douleur, au froid et à la chaleur.
Histidine. Favorise la croissance et la réparation des tissus. DANS grandes quantités contenu dans l'hémoglobine; utilisé dans le traitement polyarthrite rhumatoïde, allergies, ulcères et anémie. Un manque d'histidine peut entraîner une perte auditive.
Isoleucine. Fourni avec tous les produits contenant protéine complète- viandes, volailles, poissons, œufs, produits laitiers.
Leucine. Fourni avec tous les produits contenant des protéines complètes - viande, volaille, poisson, œufs, produits laitiers. Nécessaire non seulement à la synthèse des protéines par l'organisme, mais aussi au renforcement système immunitaire.
Lysine. Bonnes sources- fromage, poisson. L'un des composants importants dans la production de carnitine. Assure une bonne absorption du calcium; participe à la formation du collagène (à partir duquel se forment ensuite le cartilage et le tissu conjonctif) ; participe activement à la production d'anticorps, d'hormones et d'enzymes. Recherche récente ont montré que la lysine, en améliorant l'équilibre global nutriments, peut être utile dans la lutte contre l'herpès. La carence peut inclure la fatigue, l’incapacité de se concentrer, l’irritabilité, les lésions des vaisseaux sanguins des yeux, la perte de cheveux, l’anémie et les problèmes de reproduction.
Méthionine. Les bonnes sources comprennent les céréales, les noix et les céréales. Important dans le métabolisme des graisses et des protéines, l’organisme l’utilise également pour produire de la cystéine. C'est le principal fournisseur de soufre, qui prévient les troubles de la formation des cheveux, de la peau et des ongles ; aide à réduire le taux de cholestérol en améliorant la production de lécithine par le foie ; abaisse le niveau de graisse dans le foie, protège les reins ; participe à l'élimination des métaux lourds de l'organisme ; régule la formation d'ammoniac et en élimine l'urine, ce qui réduit la charge sur vessie; affecte les follicules pileux et favorise la croissance des cheveux.
Thréonine. Un composant important dans la synthèse des purines, qui, à leur tour, décomposent l'urée, sous-produit synthèse des protéines. Un composant important du collagène, de l'élastine et des protéines de l'émail ; participe à la lutte contre les dépôts graisseux dans le foie ; favorise un fonctionnement plus fluide du tractus digestif et intestinal ; participe généralement aux processus de métabolisme et d'assimilation.
Tryptophane. Elle est primordiale par rapport à la niacine (vitamine B) et à la sérotonine, qui, en participant aux processus cérébraux, contrôlent l'appétit, le sommeil, l'humeur et seuil de la douleur. Relaxant naturel, aide à combattre l'insomnie en provoquant sommeil normal; aide à combattre l'anxiété et la dépression ; aide au traitement des migraines; renforce le système immunitaire; réduit le risque de spasmes des artères et du muscle cardiaque; avec la Lysine, il lutte pour abaisser le taux de cholestérol. Au Canada et dans de nombreux pays européens, il est prescrit comme antidépresseur et somnifère. Aux États-Unis, une telle utilisation est considérée avec prudence.
Phénylalanine. Un des acides aminés essentiels. Utilisé par l'organisme pour produire de la tyrosine et trois hormones importantes : l'épinéphrine (adrénaline), la noradrénaline et la thyroxine, ainsi que le neurotransmetteur dopamine. Utilisé par le cerveau pour produire de la noradrénaline, une substance qui transmet les signaux des cellules nerveuses au cerveau ; nous garde éveillés et réceptifs; réduit la faim; Agit comme un antidépresseur et aide à améliorer la fonction de mémoire.
Acides aminés conditionnellement essentiels :
Tyrosine. Utilisé par l'organisme à la place de la phénylalanine dans la synthèse des protéines. Sources - lait, viande, poisson. Le cerveau utilise la tyrosine pour produire de la noradrénaline, ce qui augmente le tonus mental. Les tentatives visant à utiliser la tyrosine comme moyen de lutter contre la fatigue et le stress ont donné des résultats prometteurs.
Cystéine. S'il y a suffisamment de cystéine dans l'alimentation, le corps peut l'utiliser à la place de la méthionine pour fabriquer des protéines. Les bonnes sources de cystéine comprennent la viande, le poisson, le soja, l'avoine et le blé. La cystéine est utilisée dans l'industrie alimentaire comme antioxydant pour préserver la vitamine C dans les produits finis.
Acides aminés essentiels:
Alanine. C'est une source d'énergie importante pour les tissus musculaires, le cerveau et le système nerveux central ; renforce le système immunitaire en produisant des anticorps ; participe activement au métabolisme des sucres et des acides organiques.
Arginine. La L-Arginine provoque un ralentissement du développement des tumeurs et des cancers. Nettoie le foie. Aide à libérer l’hormone de croissance, renforce le système immunitaire, favorise la production de spermatozoïdes et est utile dans le traitement des troubles et des blessures rénales. Indispensable pour la synthèse des protéines et une croissance optimale. La présence de L-Arginine dans l’organisme favorise une augmentation de la masse musculaire et une diminution des réserves de graisse corporelle. Également utile pour les troubles hépatiques comme la cirrhose du foie par exemple. Utilisation déconseillée aux femmes enceintes et allaitantes.
Asparagine. Acide aspartique Participe activement à l'élimination de l'ammoniac, nocif pour le système nerveux central. Des recherches récentes ont montré que l'acide aspartique peut améliorer la résistance à la fatigue.
Glutamine. Important pour normaliser les niveaux de sucre, augmenter les performances cérébrales, dans le traitement de l'impuissance, dans le traitement de l'alcoolisme, aide à combattre la fatigue, troubles cérébraux- l'épilepsie, la schizophrénie et simplement la léthargie, nécessaires au traitement des ulcères d'estomac et à la formation d'un corps sain tube digestif. Dans le cerveau, il est converti en acide glutamique, important pour le fonctionnement cérébral. Lorsqu'elle est utilisée, la glutamine ne doit pas être confondue avec l'acide glutamique ; ces médicaments diffèrent par leur action les uns des autres. L'acide glutamique est considéré comme un « carburant » naturel pour le cerveau et améliore les capacités mentales. aide à accélérer la guérison des ulcères, augmente la résistance à la fatigue.
Glycine. Participe activement à l'apport d'oxygène au processus de formation de nouvelles cellules. C'est un acteur important dans la production d'hormones responsables du renforcement du système immunitaire.
Carnitine. La carnitine est un agent de transport Les acides gras dans la matrice mitochondriale. Le foie et les reins produisent de la carnitine petite quantité de deux autres acides aminés - la lysine et la méthionine. De grandes quantités sont apportées à l'organisme par la viande et les produits laitiers. En empêchant l’accumulation de réserves de graisse, cet acide aminé est important pour perdre du poids et réduire le risque de maladie cardiaque. Le corps produit de la Carnitine uniquement en présence quantité suffisante lysine, fer et enzymes B19 et B69. Les végétariens sont plus sensibles à la carence en carnitine car ils contiennent beaucoup moins de lysine dans leur alimentation. La carnitine augmente également l'efficacité des antioxydants - les vitamines C et E. On pense que pour une meilleure utilisation des graisses norme quotidienne la carnitine devrait être de 1 500 milligrammes.
Ornithine. L'ornithine favorise la production d'hormone de croissance qui, en combinaison avec la L-Arginine et la L-Carnitine, favorise le recyclage des excès de graisse dans le métabolisme. Indispensable au fonctionnement du foie et du système immunitaire.
Proline. Extrêmement important pour bon fonctionnement ligaments et articulations; participe également au maintien des performances et au renforcement du muscle cardiaque.
Sérine. Participe au stockage du glycogène par le foie et les muscles ; participe activement au renforcement du système immunitaire en lui fournissant des anticorps ; forme des « gaines » graisseuses autour des fibres nerveuses.
Taurine. Stabilise l'excitabilité membranaire, ce qui est très important pour le contrôle crises d'épilepsie. La taurine et le soufre sont considérés comme essentiels pour contrôler les nombreux changements biochimiques qui se produisent au cours du processus de vieillissement ; participe à libérer l'organisme de la contamination par les radicaux libres.
Effets des acides aminés
- Source d'énergie. Les acides aminés sont métabolisés différemment des glucides, de sorte que le corps peut recevoir beaucoup plus d'énergie pendant l'entraînement si le pool d'acides aminés est plein.
- Accélération de la synthèse des protéines. Les acides aminés stimulent la sécrétion de l'hormone anabolisante - l'insuline, et activent également mTOR, deux de ces mécanismes peuvent déclencher la croissance musculaire. Les acides aminés eux-mêmes sont utilisés comme Matériau de construction pour les protéines.
- Suppression du catabolisme. Les acides aminés ont un effet anticatabolique prononcé, particulièrement nécessaire après l'entraînement, ainsi que pendant un cycle de perte de poids ou de coupe.
- La combustion des graisses. Les acides aminés favorisent la combustion des graisses grâce à l'expression de la leptine dans les adipocytes via mTOR
Formes d'acides aminés
Les acides aminés sont disponibles sous forme de poudre, de comprimés, de solutions, de gélules, mais toutes ces formes sont équivalentes en efficacité. Il existe également des formes injectables d’acides aminés administrées par voie intraveineuse. L’injection d’acides aminés n’est pas recommandée car elle ne présente aucun avantage par rapport à par la bouche, mais il existe un risque élevé de complications et d'effets indésirables.
Quand prendre des acides aminés
Lors de la prise de masse musculaire, il est préférable de prendre des acides aminés uniquement avant et après l'entraînement, ainsi que (éventuellement) le matin, car à ces moments-là, un apport élevé en acides aminés est nécessaire. À d’autres moments, il est plus sage de prendre des protéines. Lors de la perte de poids, les acides aminés peuvent être pris plus souvent : avant et après l'entraînement, le matin et entre les repas, puisque le but de leur utilisation est de supprimer le catabolisme, de réduire l'appétit et de préserver les muscles.
Il est souhaitable qu'une dose unique soit d'au moins 5 g, bien que le résultat maximum soit obtenu en consommant 10 à 20 g une fois.
Qu'est-ce que rôle biologique acides aminés? Essayons de trouver ensemble la réponse à cette question. Identifions les caractéristiques structurelles de cette classe matière organique, leurs propriétés chimiques, principaux domaines d'application.
Information historique
Le premier acide aminé découvert était la glycine. Il a été synthétisé en 1820 par hydrolyse acide de la gélatine. Il n’a été possible de déchiffrer la composition en acides aminés des molécules de protéines qu’au milieu du siècle dernier, et c’est alors que l’acide aminé thréonine a été identifié.
Fonctions principales
Actuellement, il existe des informations sur 300 acides aminés qui remplissent diverses fonctions dans le corps.
Quel est leur principal rôle biologique ?Ils sont considérés comme standards (protéinogènes), car ils font partie des principales molécules protéiques.
Ces composés font partie de certaines protéines. L'oxypriline est à la base du collagène, l'élastine est formée par la desmosine.
Il peut s'agir de substances intermédiaires dans processus métaboliques. Cette fonction est assurée par la citrulline et l'ornithine.
Le biologique comprend également la synthèse de nucléotides et de polyamides. La chaîne carbonée de ces composés est utilisée pour former d’autres substances organiques :
- le glucose est synthétisé à partir d'acides aminés glucogéniques ;
- les lipides sont formés par des composés cétogènes.
Le rôle biologique des acides aminés réside dans la possibilité de leur utilisation pour déterminer des groupes fonctionnels. La cystéine est utilisée pour identifier le groupe sulfate. L'aspartate est utilisé pour identifier le groupe amino.

Caractéristiques de la nomenclature
Comment nommer correctement la classification, le rôle biologique de ces composés est discuté même dans le programme scolaire.
Les acides aminés sont des dérivés d'acides carboxyliques dans lesquels un atome d'hydrogène est remplacé par un groupe amino.
Selon la localisation de ce groupe fonctionnel, plusieurs isomères peuvent exister pour un même composé. Les chimistes en utilisent trois à la fois, triviaux et systématiques.
Les noms triviaux de ces composés sont associés à la source à partir de laquelle ils ont été isolés. La sérine est incluse dans la fibroïne de soie, la glutamine se trouve dans le gluten des plantes céréalières. La cystine est présente dans les calculs vésicaux.
Le nom rationnel est associé à un dérivé de l'acide carboxylique et la désignation abrégée est utilisée pour indiquer la séquence d'acides aminés dans une molécule protéique. En biochimie, des noms abrégés et triviaux sont utilisés pour ces composés.
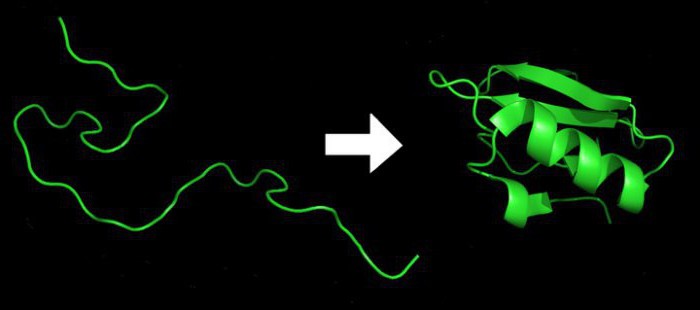
Classification des acides aminés
Afin de comprendre le rôle biologique des acides aminés et leur utilisation, attardons-nous plus en détail sur les types de classification de ces composés organiques.
Actuellement, plusieurs types de classification sont utilisés :
- par radical;
- selon le degré de sa polarité ;
- selon la variante de synthèse dans l'organisme.
Selon la structure du radical en chimie organique, il existe différents types acides aminés.
Les composés aliphatiques peuvent contenir un groupe carboxyle et un groupe amino, auquel cas ce sont des composés monoaminocarbonés.
En présence de deux COOH et d'un groupe amino, les substances sont appelées substances monoaminodicarboxyliques.
Les formes diaminomonocarboxyliques et diaminodicarboxyliques d'acides aminés sont également isolées.
Les espèces cycliques diffèrent non seulement par le nombre de cycles, mais aussi par leur composition qualitative.
Selon Lehninger, les acides aminés sont divisés en quatre groupes selon les caractéristiques de l'interaction du radical hydrocarboné avec l'eau :
- hydrophobe;
- hydrophile;
- chargé négativement;
- chargé positivement.
En fonction de la capacité des acides aminés à être synthétisés dans le corps humain, on distingue les types essentiels (fournis avec la nourriture) et non essentiels.
De nombreuses expériences scientifiques ont prouvé le rôle biologique des acides alpha-aminés.

Propriétés physiques
Par quoi se caractérisent les acides aminés ? La nomenclature, les propriétés et le rôle biologique de ces composés sont proposés aux bacheliers lors de l'examen d'État unifié de chimie. Ces acides organiques sont très solubles dans l’eau et ont un point de fusion élevé.
Leur activité optique s'explique par la présence d'un atome de carbone asymétrique dans les molécules (la seule exception est la glycine). C'est pourquoi les stéréoisomères L et D des acides aminés ont été découverts.
Les isomères de la série L se trouvent dans les protéines animales. La valeur du pH de ces composés est comprise entre 5,5 et 7.

Propriétés chimiques
Examinons de plus près les acides aminés. La structure, les propriétés chimiques, le rôle biologique de ces substances organiques doivent être connues.
La spécificité des propriétés chimiques des acides aminés réside dans leur dualité. La raison de l'amphotéricité est la présence de deux groupes fonctionnels dans la composition de ces acides organiques.
La présence du groupe carboxyle COOH confère à ces composés un caractère acide. Ils interagissent facilement avec métaux actifs, oxydes basiques, alcalis. De plus, l'acidité des propriétés de ces composés organiques se manifeste dans la réaction d'estérification (ils forment des esters avec des alcools).
Les acides aminés peuvent également entrer dans réaction chimique avec des sels formés par des acides minéraux. A titre d'exemple d'une telle réaction, nous pouvons considérer l'interaction des acides aminés avec les bicarbonates et les carbonates.
Les principales propriétés de cette classe sont la capacité des acides aminés à réagir avec d’autres acides du groupe amino. Dans ce cas, des sels se forment.
Le rôle biologique de la décarboxylation des acides aminés est de former un environnement neutre, absolument sans danger pour un organisme vivant.
Vous permet de détecter les acides aminés en solution. L'essence de la réaction est qu'une solution incolore de ninhydrine, lorsqu'elle interagit avec un acide aminé, se condense sous la forme d'un dimère à travers un atome d'azote, qui est séparé du groupe amino de l'acide correspondant.
Le pigment obtenu a une teinte rouge-violet. De plus, une décarboxylation de l'acide aminé se produit, ce qui entraîne la formation d'un certain aldéhyde et de monoxyde de carbone (4).
C'est la réaction à la ninhydrine que les biologistes utilisent pour analyser la structure primaire des molécules protéiques. L'intensité de la couleur peut révéler la teneur quantitative en acides aminés dans la solution d'origine, une telle analyse est donc appropriée pour déterminer la concentration en acides aminés.

Réactions spécifiques
Les acides aminés, en plus des groupes carboxyle et amino, peuvent contenir des groupes fonctionnels supplémentaires. Pour les déterminer, des réactions qualitatives sont réalisées dans des laboratoires de recherche.
L'arginine peut être détectée dans un mélange en effectuant réaction qualitative Sakaguchi (pour le groupe guanidine). La cystéine peut être déterminée par la méthode Foll spécifique au groupe SH.
La réaction de nitration (réaction xanthoprotéique) permet de confirmer la présence d'un acide aminé aromatique dans le mélange. La réaction de Millon est conçue pour identifier le groupe hydroxyle sur le cycle aromatique de la tyrosine.
Caractéristiques de la liaison peptidique
Leurs caractéristiques : Leur rôle biologique est associé à la formation de molécules peptidiques. Lorsque plusieurs molécules d’acides aminés interagissent les unes avec les autres, les molécules d’eau se séparent et les résidus d’acides aminés forment des peptides en utilisant des liaisons peptidiques (amide).
Le nombre de résidus d'acides aminés qui forment un polypeptide varie considérablement. Les peptides qui ne contiennent pas plus de dix résidus d'acides aminés sont appelés oligopeptides. Le nom du composé résultant indique souvent le nombre de résidus d'acides aminés.
Si une substance contient plus de dix résidus d’acides aminés, les composés sont appelés polypeptides. Pour les composés contenant plus de cinquante résidus d’acides aminés, le produit de leur synthèse est appelé protéine.
Ainsi, l'hormone glucagène, qui contient 29 acides aminés, est appelée hormone par les biologistes. Les résidus d'acides aminés sont considérés comme les monomères des acides organiques d'origine à partir desquels les composés protéiques sont formés.
Le résidu d'acide aminé qui est écrit à gauche a un groupe amino, est appelé N-terminal, le fragment qui a un groupe carboxyle est considéré comme C-terminal et est généralement écrit à droite.
Lors de la dénomination du polypeptide résultant, des noms abrégés des acides aminés à partir desquels il est formé sont utilisés. Par exemple, si la glycine, la sérine et l’alanine étaient impliquées dans l’interaction, le tripeptide résultant sera lu comme la glycylsérylalanine.

L'importance de certains acides aminés
La glycine (acide aminoacétique) est un donneur de fragments de carbone nécessaires à la formation de l'hémoglobine, du pyrrole, de la choline, des nucléotides, ainsi qu'à la synthèse de la créatine.
La sérine est présente dans les sites actifs des enzymes. Cet acide aminé est nécessaire à la synthèse de la phosphoprotéine (caséine naturelle du lait).
L'acide glucogénique est nécessaire à la formation de la structure secondaire et tertiaire de la molécule protéique. Ce composé contient le groupe fonctionnel le plus réactif, de sorte que la substance entre facilement dans les processus redox et se lie métaux lourds sous forme de composés insolubles. C'est cette substance qui agit comme donneur du groupe sulfate, nécessaire à la synthèse des substances contenant du soufre.
Conclusion
Les acides aminés sont amphotères composés organiques, qui ont une signification biologique importante. Ce sont les résidus d'acides aminés au cours du processus de synthèse qui forment la séquence, qui constitue la structure primaire de la molécule protéique. En fonction de l'alignement exact des fragments d'acides aminés, une protéine spécifique à chaque organisme vivant est synthétisée.




